
1 Контрольная работа / 1- 7_Химия (1контр-вар7_Химия.doc)
.doc
Томский межвузовский центр дистанционного образования
Томский государственный университет
систем управления и радиоэлектроники (ТУСУР)
Контрольная работа № 1
по дисциплине «Химия»
авторы учебного пособия:
Смирнов Г.В.
Якунина Г.Н.
вариант №7
1) Закончить уравнения реакций
а) Pb(NO3)2 + 2NaOH = Pb(OH)2 + 2NaN03
Pb2+ +
2N![]() + 2Na+
+ 2O
+ 2Na+
+ 2O![]() = Pb(OH)2 +
2Na+ +
2N
= Pb(OH)2 +
2Na+ +
2N![]()
Pb2+
+ 2O![]() = Pb(OH)2
= Pb(OH)2
б) 2Pb + O2 = 2PbO
в) PbO + 2NaOH = Na2PbO2 + H2O
PbO + 2Na+
+ 2O![]() = 2Na+ + Pb
= 2Na+ + Pb![]() + H2O
+ H2O
PbO + 2O![]() =
Pb
=
Pb![]() +
H2O
+
H2O
г) Pb(OH)NO3 + HNO3 = Pb(NO3)2+ H2O
PbOH+
+ N![]() + H++
N
+ H++
N![]() = Pb2+
+ 2N
= Pb2+
+ 2N![]() + H2O
+ H2O
PbOH+
+
![]() =
Pb2++
H2O
=
Pb2++
H2O
д) PbH4
![]() Pb
+ 2H2
Pb
+ 2H2
е) PbH4 +2O2
![]() PbO2
+ 2H2O
PbO2
+ 2H2O
ж) SnCl4 + 4NaOH = Sn(OH)4 + 4NaCl
Sn4+
+ 4![]() +
4Na+
+4O
+
4Na+
+4O![]() =
Sn(OH)4
+ 4Na+
+ 4
=
Sn(OH)4
+ 4Na+
+ 4![]()
Sn4+
+ 4O![]() =
Sn(OH)4
=
Sn(OH)4
з) CuSO4 + Fe = FeSO4 + Cu
Cu2+
+ S![]() +
Fe0 =
Fe2+ +
S
+
Fe0 =
Fe2+ +
S![]() +
Cu0
+
Cu0
Cu2+ + Fe0 = Fe2+ + Cu0
и) Cu(OH)2
![]() CuO
+ H2O
CuO
+ H2O
к) Ga + As = GaAs
По реакции (д) получают свинец, пластичность которого допускает изготовление его в рулонах (рольный свинец). Рольный свинец применяют для защиты металлических стенок различных реакторов. Для защиты аппаратов применяют и свинцевание – непосредственное нанесение на поверхность металла гомогенного слоя свинца. Для защиты от атмосферной коррозии толщина покрытия должна составлять 0,1– 0,2 мм. Для защиты химической аппаратуры толщина защитного слоя достигает 16 мм.
С помощью реакции (з) железную конструкцию покрывают слоем меди. Это пример катодной защиты железной конструкции от коррозии.
а) 2Mn(OH)3 + H2CO3 = (Mn(OH)2)2CO3 + 2H2O
двухосновный
карбонат марганца (III)
H – O
– O
Mn – O
H
 – O
– O
C = O
H
 – O
– O
 Mn – O
Mn – O
H – O
б) Mn(OH)3 + H2CO3 = MnOHCO3 + 2H2O
одноосновный
карбонат марганца (III)

 O
O
H
 – O – Mn C = O
– O – Mn C = O
O
в) 2Mn(OH)3 + 3H2CO3 = Mn2(CO3)3 + 6H2O
карбонат
марганца(III)

 O –– C = O
O –– C = O
Mn –– O

 O
O
 C
= O
C
= O
 O
O
M n
–– O –– C = O
n
–– O –– C = O
 O
O
г) Mn(OH)3 + 3H2CO3 = Mn(HCO3)3 + 3H2O
гидрокарбонат
марганца (III)
O – H
|
 O
–– C = O
O
–– C = O
M n
–– O –– C
= O
n
–– O –– C
= O
|
O – H
O –– C = O
|
O – H
-
Дано: ∆
 (NH3)
= - 46,19 кДж/моль
(NH3)
= - 46,19 кДж/моль
t1 = 25˚C ∆![]() (O2)
= 0 кДж/моль
(O2)
= 0 кДж/моль
t2 = 500˚C ∆![]() (H2Oж)
= - 241,84 кДж/моль
(H2Oж)
= - 241,84 кДж/моль
__________ ∆![]() (NO)
= 90,34 кДж/моль
(NO)
= 90,34 кДж/моль
∆G298 – ? ![]() (NH3)
= 192,5 Дж/(моль*к)
(NH3)
= 192,5 Дж/(моль*к)
∆G773 – ? ![]() (O2)
= 205,03 Дж/(моль*к)
(O2)
= 205,03 Дж/(моль*к)
![]() (H2Oж)
= 188,74 Дж/(моль*к)
(H2Oж)
= 188,74 Дж/(моль*к)
![]() (NO)
= 210,62 Дж/(моль*к)
(NO)
= 210,62 Дж/(моль*к)
Решение:
4NH3 + 5O2 = 6H2O(ж) + 4NO
∆![]() =
∑ ∆
=
∑ ∆![]() – ∑ ∆
– ∑ ∆![]() =
6∆
=
6∆![]() +
4∆
+
4∆![]() –
4∆
–
4∆![]() –
5∆
–
5∆![]() =
6*(-241,84) +
=
6*(-241,84) +
+ 4*90,37 – 4*(-46,19) – 5*0 = -904,8 кДж
∆![]() = ∑
= ∑![]() – ∑
– ∑
![]() =
6
=
6![]() +
4
+
4![]() –
4
–
4![]() –
5
–
5![]() =
6*188,74 + 4*210,62 –
=
6*188,74 + 4*210,62 –
– 4*192,5 – 5*205,03 = 179,77 Дж = 0,17977 кДж
T1 = 25 + 273 = 298 K
∆G298
= ∆![]() –
T∆S = -904,8 кДж – 298*0,17977 =
-958,4 кДж
–
T∆S = -904,8 кДж – 298*0,17977 =
-958,4 кДж
Такое значение ∆G298 указывает на то, что реакция протекает в прямом направлении.
T2 = 500 + 273 = 773 K
∆G773 = -904,8 – 773*0,17977 = -1043,8кДж
∆G773 имеет более отрицательное значение, чем ∆G298, следовательно, реакция продолжает протекать в прямом направлении. Таким образом, повышение температуры на направление данной реакции не влияет.
Количество теплоты, выделившейся или поглотившейся в результате реакции, зависит только от относительного запаса энергии продуктов и исходных веществ. Если этот относительный запас энергии измерен при постоянном давлении, он называется энтальпией. Направление, в котором самопроизвольно протекает химическая реакция, определяется совместным действием двух факторов: 1) тенденцией к переходу системы в состояние с наименьшей внутренней энергией (с наименьшей энтальпией); 2) тенденцией к достижению более вероятного состояния, перехода из более упорядоченного состояния в менее упорядоченное (с наибольшей энтальпией). Энтропия является количественной мерой беспорядка в системе.
Изменение энергии Гиббса одновременно учитывает изменение энергетического запаса системы и степени ее беспорядка.
∆G = ∆![]() –
T∆S
–
T∆S
Таким образом, чем отрицательнее величина ∆H, тем больше отрицательная величина ∆G. И чем положительнее величина ∆S, тем больше отрицательна величина ∆G. Рассмотрение приведенного уравнения зависимости ∆G реакции от ∆H и ∆S приводит к следующим выводам:
-
если ∆H < 0 и ∆S > 0, то ∆G < 0, т.е. экзотермическая реакция с увеличением энтропии в системе возможна при всех температурах;
-
если ∆H > 0, а ∆S < 0, то ∆G > 0, т.е. эндотермическая реакция с уменьшением энтропии в системе невозможна ни при каких температурах;
-
если ∆H < 0 и ∆S < 0 или ∆H > 0 и ∆S > 0, то знак при ∆G зависит от соотношения величин ∆
 и
T∆S, но
реакция возможна только в случае ∆G
< 0.
и
T∆S, но
реакция возможна только в случае ∆G
< 0.
-
4MnO2 = 2Mn2O3 + O2 (1) ∆
 = -212,55 кДж
= -212,55 кДж
6Mn2O3
= 4Mn3O4
+ O2
(2) ∆![]() = -156,94 кДж
= -156,94 кДж
Утроим первой уравнение реакции и сложим его со вторым. Получим:
12MnO2 + 6Mn2O3 = 6Mn2O3 + 3O2 + O2 + 4Mn3O4
Сократим 6Mn2O3 в левой и правой частях этого уравнения, а коэффициенты перед оставшимися веществами сократим на 4. Получим:
3 MnO2 = Mn3O4 + O2
∆![]() = 3*∆H1
+ ∆H2
= 3*(-212,55) + (-156,94) = -794,59
кДж
= 3*∆H1
+ ∆H2
= 3*(-212,55) + (-156,94) = -794,59
кДж
Ответ: ∆![]() = -794,59 кДж
= -794,59 кДж
-
-
2NO + O2 = 2NO2 ∆
 =
-112,6 кДж
=
-112,6 кДж
-
Первоначальные скорости прямой и обратной реакции были следующие:
υпр = K1*![]() *
*![]() ; υобр
= K2*
; υобр
= K2*![]()
При увеличении давления в два раза концентрация всех реагирующих веществ увеличилась в два раза, так как общий объем системы уменьшился в два раза. Тогда скорость прямой реакции:
υ![]() = K1*(2
= K1*(2![]() )2*2
)2*2![]() =
8 K1*
=
8 K1*![]() *
*![]()
т.е. возросла в восемь раз. А скорость обратной реакции:
υ![]() =
K2*(2
=
K2*(2![]() )2
= 4 K2*
)2
= 4 K2*![]()
т.е. возросла в четыре раза. Следовательно, равновесие сместится в сторону прямой реакции.
-
N2 + 3H2 = 2NH3 ∆
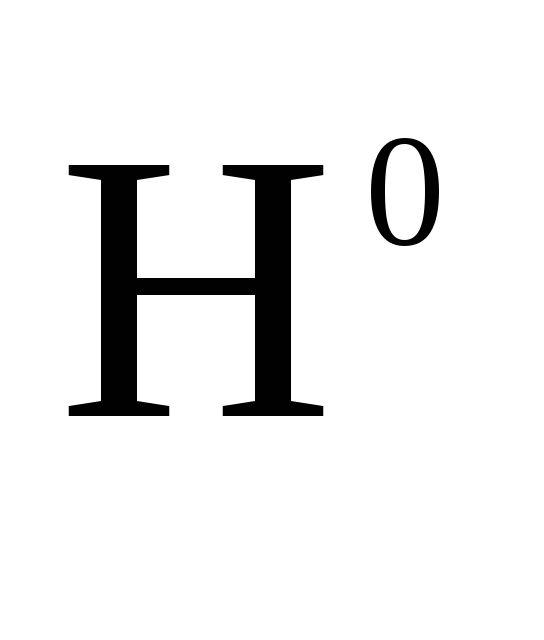 =
-92,38 кДж
=
-92,38 кДж
υпр = K1*![]() *
*![]() ; υобр
= K2*
; υобр
= K2*![]()
После увеличения давления в два раза:
υ![]() = K1*2
= K1*2![]() *(2
*(2![]() )3
= 16 K1*
)3
= 16 K1*![]() *
*![]()
т.е. скорость прямой реакции возрастает в шестнадцать раз.
υ![]() =
K2*(2
=
K2*(2![]() )2
= 4 K2*
)2
= 4 K2*![]()
т.е. скорость обратной реакции возрастает в четыре раза. Следовательно, равновесие сместится в сторону прямой реакции.
-
2H2 + O2 = 2H2O(пар) ∆
 =
-483,58 кДж
=
-483,58 кДж
υпр = K1*![]() *
*![]() ; υобр
= K2*
; υобр
= K2*![]()
После увеличения давления в два раза:
υ![]() = K1*(2
= K1*(2![]() )2*2
)2*2![]() =
8 K1*
=
8 K1*![]() *
*![]()
т.е. скорость прямой реакции возросла в восемь раз.
υ![]() =
K2*(2
=
K2*(2![]() )2
= 4 K2*
)2
= 4 K2*![]()
т.е. скорость обратной реакции возросла в четыре раза. Следовательно, равновесие сместится в сторону прямой реакции.
-
В соответствии с правилом Вант-Гоффа
υ![]() =
υ
=
υ![]() *
γ
*
γ![]()
T2 – T1 = 25
υ![]() /
υ
/
υ![]() = γ
= γ![]() = 2,3
= 2,3![]() = 2,32,5 =
= 2,32,5 =
![]() = (2,3)2 *
= (2,3)2 *
![]() = 8,023
= 8,023
Скорость реакции возрастет в 8,023 раза.
-
Данному заданию соответствует диаграмма плавкости твердого раствора. Характерной особенностью подобной системы является то, что температура плавления твердого раствора данного состава не совпадает с температурой затвердевания жидкого раствора (расплава) того же состава. Поэтому на диаграмме плавкости наблюдаются две кривые: верхняя отражает температуры затвердевания расплава (линия ликвидуса), нижняя – температуры плавления твердого раствора (линия солидуса).
Построим диаграмму системы медь-никель (Cu-Ni) и кривые охлаждения расплавов содержащих 0, 40, 100% никеля.

3-3 кривая охлаждения расплава содержащего 0% никеля;
2-2 кривая охлаждения расплава содержащего 40% никеля;
1-1 кривая охлаждения расплава содержащего 100% никеля.
Для любой области и точки на диаграмме плавкости применимо правило фаз Гиббса:
С = К + 2 – Ф
Так как мы строили диаграммы плавкости в координатах состав-температура, следовательно: С = К + 1 – Ф
Таким образом, для области 4: К = 2, Ф = 1, С = 2 + 1 – 1 = 2;
для области 5: К = 2, Ф = 3, С = 2 + 1 – 3 = 0;
для области 6: К = 2, Ф = 1, С = 2 + 1 – 1 = 2;
на линии ликвидуса: К = 2, Ф = 3, С = 2 + 1 – 3 = 0;
на линии солидуса: К = 2, Ф = 3, С = 2 + 1 – 3 = 0;
в точке А: К = 1, Ф = 1, С = 1 + 1 – 1 = 1;
в точке Д: К = 2, Ф = 2, С = 2 + 1 – 2 = 1.
Твердыми растворами называют фазы переменного состава, находящиеся в состоянии химического (термодинамического) равновесия. По механизму образования твердые растворы можно подразделить на следующие основные типы: замещения, внедрения, вычитания.
-
Твердые растворы замещения возникают в результате статистического замещения одних частиц другими в узлах кристаллической решетки растворителя. Это единственный случай при образовании твердых растворов, когда возможна полная взаимная растворимость. Например, при постепенном замещении атомов натрия в кристаллической решетке NaCl атомами калия, можно непрерывно перейти от одного чистого компонента (NaCl) к другому (KCl). Непрерывный ряд твердых растворов замещения может образоваться при значительном сходстве физико-химического характера компонента. Если же сочетание факторов, определяющих растворимость, не очень благоприятно, то наблюдается ограниченная взаимная растворимость. Обычно различают твердые растворы с катионным (NaxK1-xCl) и анионным (KClxBr1-x) замещением. Кроме того, следует различать изовалентное и гетеровалентное замещение. При изовалентном замещении атомы растворяемого вещества и растворителя имеют одинаковую валентность (AlSB – GaSb, KCl – KBr и т.п.). Гетеровалентное замещение наблюдается при разной валентности атомов растворителя и растворенного вещества. Так, твердые растворы Ga2Se3 – GaAs представляют собой пример твердых растворов с анионным гетеровалентным замещением. Встречаются более сложные варианты образования растворов замещения, когда одновременно наблюдается и катионно-анионное, и гетеровалентное замещение. Например, в системе KMnO4 – BaSO4, в катионной и анионной подрешетках осуществляется гетеровалентное замещение.
-
Твердые растворы внедрения образуются в результате встраивания атомов растворяемого вещества в междоузлия кристаллической решетки растворителя. Растворы такого типа могут быть только ограниченными. Размер внедряемого атома должен быть небольшим и оптимально соответствовать объему пустот в междоузлиях кристаллической решетки растворителя. При образовании металлических твердых растворов внедрения в качестве внедряемых атомов обычно выступают легкие неметаллы, обладающие малым радиусом: H, B, C, N, O. При этом встраивание их в пустоты решетки существенным образом не влияет на характер взаимодействия атомов и не изменяет типа кристаллической решетки. Например, твердые растворы водорода в титане и палладии, бора в переходных металлах обладают металлическими свойствами, поскольку внедрение атомов водорода и бора в кристаллические структуры соответствующих металлов, во-первых, не нарушает общего металлического характера взаимодействия атомов, а во-вторых, электроны внедряемых атомов также обобществляются.
-
Твердые растворы вычитания образуются только на основе химических соединений при недостатке одного из компонентов в соответствующей подрешетке. Типичный пример твердого раствора вычитания представляет собой фаза TiO, состав которой характеризуется формулой Ti0,75-1,00O1,00-0,58. Реально эта фаза существует как в виде твердого раствора вычитания по титану Ti0,75-1,00O (вакантна часть мест в подрешетке титана), так и в виде твердого раствора вычитания по кислороду TiO1,00-0,58 (все места в подрешетке титана заняты, а часть кислородных вакантна). Твердые растворы вычитания, как и растворы внедрения, могут быть только ограниченными.
-
1) 2Fe3O4(T) = 6FeO(T) + O2(Г)
-
Fe3O4(T) = 3Fe(T) + 2O2(Г)
-
2FeO(T) = 2Fe(T) + O2(Г)
Число степеней свободы можно выразить как разность между общим числом переменных и числом уравнений: C = K + 2 – f
В нашей системе четыре составляющих вещества: Fe(T), Fe3O4(T), FeO(T), O2(Г), но три независимых компонента, так как концентрация вещества в газовой фазе определяется константой равновесия. Число фаз четыре (три кристаллических и одна газообразная). Следовательно, С = 3 + 2 – 4 = 1. Т.е. система имеет одну степень свободы: каждой температуре соответствует определенная концентрация (или давление) O2.
