
1 Контрольная работа / 1- 7_Химия_2
.doc
Контрольная работа № 1
по дисциплине “Химия”
авторы учебного пособия: Г. В. Смирнов, Г. М. Якунина
специальность: 220200
2002 г.
Вариант 7
-
Закончить уравнения реакций:
1)
![]() 6)
6)
![]()
2)
![]() 7)
7)
![]()
3)
![]() 8)
8)
![]()
4)
![]() 9)
9)
![]()
5)
![]() 10)
10)
![]()
Какие из приведенных реакций можно использовать в технологии получения пленок (каких)? Составить ионные уравнения реакций (где возможно).
Решение:
1)
![]()
Полное ионное уравнение реакции:
![]()
Сокращенное ионное уравнение реакции:
![]()
2)
![]()
3)
![]()
4)
![]()
Полное ионное уравнение реакции:
![]()
Сокращенное ионное уравнение реакции:
![]() (вода
малодиссоциирующее вещество)
(вода
малодиссоциирующее вещество)
5)
![]()
6)
![]()
7)
![]()
Полное ионное уравнение реакции:
![]()
Сокращенное ионное уравнение реакции:
![]()
8)
![]()
9)
![]()
10)
![]()
Реакции (2), (6) образования оксида свинца можно использовать для получения противокоррозионной пленки.
-
Составить уравнения получения возможных солей между угольной кислотой и гидроксидом марганца(III). Назвать все соли и построить их графические формулы.
Решение:
Составляем возможные кислотные и основные остатки и формулы солей.
Учитывая остатки, находим, что возможно получить две основные, одну кислую и одну нормальную соли. Стрелками показаны возможные сочетания взаимодействующих остатков с образованием соответствующих солей.
|
Основные остатки |
Кислотные остатки |
Формулы солей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]() -
карбонат дигидроксомарганца
-
карбонат дигидроксомарганца

![]()
![]() -
карбонат гидроксомарганца
-
карбонат гидроксомарганца
![]()
![]()
![]() -
гидрокарбонат марганца
-
гидрокарбонат марганца

![]()
![]() -
карбонат марганца
-
карбонат марганца
![]()
3. Вычислите изменение энергии Гибса G при 25С для реакции между чистыми веществами:
![]()
по стандартным значениям энтальпий образования и абсолютных энтропий химических веществ:
![]() =
-46,19 кДж/моль;
=
-46,19 кДж/моль; ![]() = 192,50 Дж/(мольК);
= 192,50 Дж/(мольК);
![]() =
0;
=
0; ![]() = 205,03 Дж/(мольК);
= 205,03 Дж/(мольК);
![]() =
-241,84 кДж/моль;
=
-241,84 кДж/моль; ![]() = 188,74 Дж/(мольК);
= 188,74 Дж/(мольК);
![]() =
90,37 кДж/моль;
=
90,37 кДж/моль; ![]() = 210,62 Дж/(мольК).
= 210,62 Дж/(мольК).
В каком направлении (прямом или обратном) наиболее вероятен процесс?
Можно ли изменить его направление при изменении температуры до 500С? Покажите расчетом.
Какова роль энтропийного и энтальпийного факторов?
Решение
Находим изменение энтальпии и энтропии для реакции пристандартных условиях:
![]() =
[6
=
[6![]() +
4
+
4![]() ]
- [4
]
- [4![]() + 5
+ 5![]() ]
=
]
=
= [6(-241,84) + 490,37] - [4(-46,19)+50] = -1089,56 + 184,76 = - 904,8 кДж.
![]() =
[6
=
[6![]() +
4
+
4![]() ]
- [4
]
- [4![]() + 5
+ 5![]() ]
=
]
=
= [6188,74 + 4210,62] - [4192,50+5205,03] = 1974,92 - 1795,15 = 179,77 Дж.
Зависимость энергии Гиббса для данной реакции описывается уравнением:
![]()
При стандартной температуре:
![]() =
-904,8 - 298179,1510-3
= -958,2 кДж
=
-904,8 - 298179,1510-3
= -958,2 кДж
При температуре 500С (773K):
![]() =
-904,8 - 773179,1510-3
= -1043,3 кДж
=
-904,8 - 773179,1510-3
= -1043,3 кДж
Отрицательное значение энергии Гиббса указывает на то, что наиболее вероятно протекание процесса в прямом направлении.
Более
отрицательное значение
![]() по сравнению с
по сравнению с
![]() свидетельствует о том, что при 773К
равновесие реакции еще в большей степени
вправо - в сторону образования NO.
Следовательно при увеличении температуры
до 500С
направление реакции не изменится.
свидетельствует о том, что при 773К
равновесие реакции еще в большей степени
вправо - в сторону образования NO.
Следовательно при увеличении температуры
до 500С
направление реакции не изменится.
Отрицательное значение энтальпии свидетельствует о том, что реакция протекает с выделением тепла.
Положительное значение изменения энтропии S говорит о том, что реакция может протекать самопроизвольно при постоянной температуре.
4. Вычислите тепловой эффект реакции:
![]()
исходя из тепловых эффектов следующих реакций:
![]() ;
; ![]() =
-212, 55 кДж;
=
-212, 55 кДж;
![]() ;
; ![]() = -156,94 кДж
= -156,94 кДж
Решение:
Для получения заданного уравнения необходимо сложить первое уравнение умноженное на 3/4 и второе уравнение умноженное на 1/4. Соответственно, согласно закону Гесса, требуется сложить и теплоты реакций:
![]() ;
;
![]()
 ;
;
![]() ;
;
![]() =
=
![]() =
- (3212,55
+ 156,94) /4 =
=
- (3212,55
+ 156,94) /4 =
= -198, 65 кДж (реакция экзотермическая).
5. Написать уравнение закона действия масс для следующих обратимых процессов:
1)
![]() ;
; ![]() = -112,96 кДж;
= -112,96 кДж;
2)
![]() ;
; ![]() = -92,38 кДж;
= -92,38 кДж;
3)
![]() ;
; ![]() = -483,58 кДж
= -483,58 кДж
Как изменится скорость прямого и обратного процессов при увеличении давления в два раза? Будет ли наблюдаться смещение равновесия, в каком направлении?
Решение
константа равновесия выразится:
1)
 ;
;
2)
 ;
;
3)
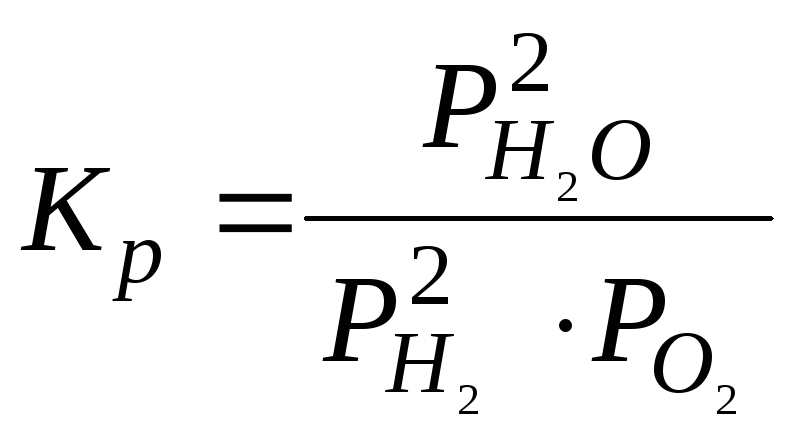 .
.
Для всех данных реакций, повышение давления будет смещать равновесие в направлении прямой реакции, так как объем исходных продуктов реакции больше конечных. Наоборот, уменьшение давления будет способствовать течению обратной реакции.
6. Температурный коэффициент скорости некоторой реакции 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на двадцать пять градусов.
Решение
В соответствии с правилом Вант-Гоффа:
![]() ,
,
где
![]() и
и
![]() - скорости химической реакции при
- скорости химической реакции при
![]() и
и
![]() ;
;
![]() -
-![]() =
25,
=
25,
![]() = 2,3.
= 2,3.
![]() ;
;
 .
.
Ответ: Скорость реакции увеличится в 8 раз.
7. На основании характерных точек кривых охлаждения построить диаграмму системы медь-никель (Cu-Ni).
|
Cu, вес % |
0 |
20 |
40 |
60 |
80 |
100 |
|
Т-ра начала кристаллизации, К |
1373 |
1467 |
1554 |
1627 |
1683 |
1728 |
|
Т-ра конца кристаллизации, К |
1373 |
1406 |
1467 |
1543 |
1629 |
1728 |
а) определить тип диаграммы и ее особенности;
б) определить число компонентов, число фаз и число степеней свободы в каждой из областей, ограниченных линиями диаграммы, на линиях и точках (по Вашему выбору). Что значит число степеней свободы?
в) построить кривые охлаждения для расплавов, содержащих 0, 40 и 100% никеля. Что понимается под твердым раствором? Типы твердых растворов.
Решение
Под числом степеней свободы понимается число термодинамических параметров (температура, давление, концентрации компонентов), определяющих состояние системы, которые можно произвольно изменять (независимо один от другого) без изменения числа фаз в системе.
При одновременной кристаллизации двух компонентов в бинарной системе число степеней свободы равно нулю:
К = 2; Ф = 3 (две твердых и одна жидкая фаза). С = К + 1 – Ф = 2 + 1 – 3 =0.
Твердые растворы можно определить как фазы переменного состава, находящиеся в состоянии химического (термодинамического) равновесия. Существует 3 типа твердых растворов:
-
твердые растворы замещения (NaCl, KCl), которые возникают в результате статистического замещения одних атомов другими в узлах кристалической решетки;
-
твердые растворы внедрения, образующиеся в результате встраивания атомов растворимого вещества в междоузлия кристалической решетки растворителя (Me + H, B, C и др.);
-
твердые растворы вы…. Образуются только на основе хим.соединений при недостатке одного из компонентов в соответствующей подрешетке (TiO).
8. При 500 – 600 C в системе, состоящей из железа, его оксидов и кислорода, возможно существование равновесий:
1)
![]() ;
;
2)
![]() ;
;
3)
![]()
Примените к данной системе правило фаз Гиббса.
Решение
Данная термодинамическая система включает две фазы: твердую и газообразную. Твердая фаза представлена железом и его оксидами, газообразная – кислородом. Система состоит из 5 индивидуальных веществ (Fe3O4, FeO, FeO4, Fe, O2) и является двухкомпонентной, так как для образования всех фаз достаточно любых двух веществ (O2 и Fe или O2 и любой оксид). Поскольку они связаны между собой стехиометрическим уравнением для каждого уравнения системы (g=1), тогда K = R –g = 3 – 1 = 2.
Правило фаз Гиббса определяет связь между числом внешних и внутренних факторов равновесия и числом сосуществующих фаз. Из внешних факторов равновесия для данной химической системы наибольшее значение имеет температура, влиянием остальных можно пренебречь. Внутренние факторы определяются числом K независимых компонентов системы. Тогда общее число факторов, определяющих фазовое равновесие, равно K+1, где 1 соответствует внешнему фактору. Число степеней свободы C - определяется как разность между максимально возможным числом фаз K+1 и действительно существующим числом фаз в системе:
C = K + 1 – Ф, C = 2 + 1 – 2 = 1.
Ф + C = K +1.
Т.е. система является моновариантной, имеющей одну степень свободы.
Литература.
-
Смирнов Г. В., Якунина Г. М. Химия.Учебное пособие., Томск, 2000 г.
-
Смирнов Г. В., Якунина Г. М. Химия.Учебное методическое пособие.,
Томск, 2000 г.
-
Рудзитис Г. Е., Фельдман Ф. Г. Химия: Неорган. химия: Учеб. для 8 класса общеобразоват. учреждений., М.: Просвещение, 2001 г.
-
Рудзитис Г. Е., Фельдман Ф. Г. Химия: Неорган. химия. Орган. химия: Учеб. для 9 класса общеобразоват. учреждений., М.: Просвещение, 2000 г.




