
1 Контрольная работа / 1- 6_Химия_2
.DOCМинистерство образования
Российской Федерации
ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
СИСТЕМ УПРАВЛЕНИЯ И РАДИОЭЛЕКТРОНИКИ (ТУСУР)
Контрольная работа №1
по дисциплине «Химия»
вариант № 6
Студент
2003
1. Написать формулы
гидроксидов,
соответствующих оксидам:
![]() ;
;
![]()
![]() .
Какими свойствами ( основными, кислотными,
амфотерными) обладают оксиды и
соответствующие им гидроксиды ? Назвать
и построить их графические формулы.
Определить эквивалент и эквивалентную
массу для соединений:
.
Какими свойствами ( основными, кислотными,
амфотерными) обладают оксиды и
соответствующие им гидроксиды ? Назвать
и построить их графические формулы.
Определить эквивалент и эквивалентную
массу для соединений:
![]()
![]() основные
св-ва.
основные
св-ва.
![]() основные
св-ва.
основные
св-ва.
![]() основные
св-ва.
основные
св-ва.
![]() амфотерные св-ва.
амфотерные св-ва.
![]() кислотные св-ва.
кислотные св-ва.
![]() амфотерные
св-ва.
амфотерные
св-ва.
![]() кислотные св-ва.
кислотные св-ва.
![]() гидроксид
калия
гидроксид
калия
![]()
![]()
 гидроксид
неодима
гидроксид
неодима
![]()
![]()
![]() гидроксид
хрома (II)
гидроксид
хрома (II)
![]()
![]()
 гидроксид
хрома (III)
гидроксид
хрома (III)
![]()

![]()
![]()
![]()
 хромовая кислота.
хромовая кислота.
![]()

![]()

![]()

![]()
![]()
![]() гидроксид
железа (III).
гидроксид
железа (III).
![]()
![]()
![]()
![]()
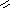
![]() азотная
кислота
азотная
кислота
![]()

![]()
![]()
Эквивалент и эквивалентная масса:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
2. Закончить уравнения:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
3. Вычислите стандартную энтальпию образования газообразного HBr на основании следующих данных (298 К).
1)![]()
![]()
2)
![]()
![]()
3)
![]()
![]()
4)
![]()
![]()
Решение:
![]()
![]()
![]()
![]()
![]() ,
,![]() - как простые вещества.
- как простые вещества.
![]()
![]()
4) Исходя из реакций:
![]()
![]()
вычислить
уравнение реакции:
![]()
Решение:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
5) Реакция
![]() протекает в замкнутом сосуде при
постоянной температуре: исходные
вещества взяты в эквивалентных
количествах. К моменту наступления
равновесия остаётся 50% начального
количества
протекает в замкнутом сосуде при
постоянной температуре: исходные
вещества взяты в эквивалентных
количествах. К моменту наступления
равновесия остаётся 50% начального
количества
![]() .
Определите давление равновесной газовой
смеси, если первоначальное давление
равнялось 100кПа (750 мм. рт. ст.).
.
Определите давление равновесной газовой
смеси, если первоначальное давление
равнялось 100кПа (750 мм. рт. ст.).
По условию задачи
на 1 моль СО приходится 1 моль Cl![]() .
К моменту равновесия в реакцию вступило
50%
.
К моменту равновесия в реакцию вступило
50%
![]() 0,5 моль СО и 0,5 моль Cl
0,5 моль СО и 0,5 моль Cl![]() ,
при этом образовалось 0,5 моль
,
при этом образовалось 0,5 моль
![]() .
.
Общее число молей газов составляло до протекания реакции 1+1=2 моль, а после достижения равновесия 0,5+0,5+0,5=1,5 моль.
Давление при равновесии () определяется из пропорции:
![]()
6) Каталитическое
окисление аммиака выражается общим
уравнением
![]() .
Через некоторое время после начала
реакции концентрации стали:
.
Через некоторое время после начала
реакции концентрации стали:
![]() Вычислите исходные концентрации аммиака
и кислорода, и константы равновесия
Вычислите исходные концентрации аммиака
и кислорода, и константы равновесия
![]() и
и
![]() ,
если реакция протекала при
,
если реакция протекала при
![]()
![]()
Исходные концентрации веществ складываются из концентрации веществ оставшихся к моменту времени и концентрации израсходованных.
![]()
Вещества расходуются
на образование
![]() .
.
![]() к моменту времени.
Согласно уравнению из 4– х молей
к моменту времени.
Согласно уравнению из 4– х молей
![]() образуется
4 моля
образуется
4 моля
![]() ,
следовательно
,
следовательно
![]() .
.
![]()
Аналогично для кислорода:
![]()
![]()
![]()
![]()



7) По приведенным кривым охлаждения построить диаграмму состояния системы Висмут – Сурьма.
По диаграмме определить:
а) тип диаграммы и её особенности;
б) каков исходный
состав сплава, если при
![]() половина
его затвердела;
половина
его затвердела;
в) 70% - ный твёрдый раствор находится в равновесии с жидким. Каков состав жидкого раствора?
г) 50 г. сплава,
содержащего 60% сурьмы, нагреты до
![]() .
Сколько сурьмы осталось в твердом
растворе? Сколько висмута перешло в
жидкий раствор?
.
Сколько сурьмы осталось в твердом
растворе? Сколько висмута перешло в
жидкий раствор?
На диаграмме состояния системы Висмут – Сурьма по вертикальной оси откладываем температуру, а по горизонтальной оси - состав сплава (концентрацию сурьмы). Точки А и В – температуры плавления компонентов системы:
т. А – t.
плав.![]()
т. В – t.
плав.
![]()

По данной диаграмме определяем:
а) Это диаграмма
состояния для сплавов с неограниченной
растворимостью в твердом состоянии.
Вид кривых плавления и затвердевания
обусловлен тем, что кристаллы выделяющиеся
при охлаждении расплава, всегда содержат
оба компонента, кроме кристаллизации
чистых
![]() и
и
![]() в точках А и В.
в точках А и В.
б) При
![]() половина сплава затвердевает; исходный
состав сплава 42%
половина сплава затвердевает; исходный
состав сплава 42%
![]() и 58%
и 58%![]() .
.
в) Состав жидкого
раствора: 23 %
![]() и 77 %
и 77 %
![]() .
.
г) 50 г. сплава,
содержащего 60% сурьмы, нагрели до
![]() .
.
Содержание сурьмы
в этом сплаве:
![]()
![]() В образовавшемся растворе содержится
32 %
В образовавшемся растворе содержится
32 %
![]() и 68 %
и 68 %
![]() ,
масса
,
масса
![]() в 50г. сплава:
в 50г. сплава:
![]() -
осталось в твердом растворе.
-
осталось в твердом растворе.
![]() .
– было в твердом растворе.
.
– было в твердом растворе.
Масса
![]() перешедшего
в жидкий раствор :
перешедшего
в жидкий раствор :
![]()
8) В керамическом производстве при разных температурах протекают реакции:
![]()
![]()
Примените правило фаз к каждой реакции.
Математическое выражение правила фаз: С=К+1-Ф
В равновесной
гетерогенной системе
![]()
К = 2 - два независимых компонента
1 - один параметр (температура)
Ф = 3 – три фазы
С = 2 + 1 – 3 = 0 – степеней свободы нет.
В равновесной
гетерогенной системе
![]()
![]()
К = 3 – три независимых компонента
1 – один параметр (температура)
Ф = 3 – три фазы
С = 3 + 1 – 3 = 1 – одна степень свободы.
