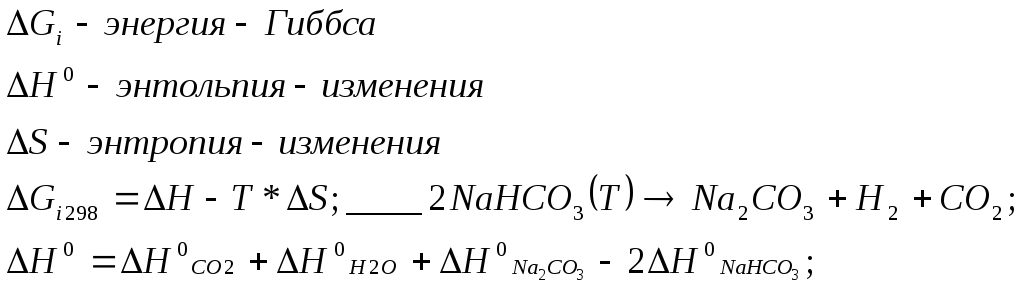1 Контрольная работа / 1- 9_Химия_2
.docТомский Государственный Университет Систем Управления и Радиоэлектроники (ТУСУР)
Контрольная работа №1
по предмету: Химия
Вариант №9
Выполнил:
Проверил:
2002г.
Задание №1
С![]() оль
слабой кислоты и слабого основания
нельзя получить
оль
слабой кислоты и слабого основания
нельзя получить
Реакцией обмена растворов ,так как они гидролизируются
До конца с образованием нерастворимого основания и
Слабой кислоты
З адание
№2
адание
№2
Дано:
Масса(Cu)=80г.
Масса(Cu)>на 7.5%
Найти:
Масса(Ag) в растворе ?
Решение:
1 .m-пластинки
соответствует 7.5%
.m-пластинки
соответствует 7.5%
2 .1
моль Cu
вытесняет из р-ра 2 моля Ag,
что приводит к увеличению mассы
Cu
пластинки на 216-64=152гр.
.1
моль Cu
вытесняет из р-ра 2 моля Ag,
что приводит к увеличению mассы
Cu
пластинки на 216-64=152гр.
3. Количество выделившегося Ag приведшее к увеличениюмассы из прапорции 216гр. Ag увелич. на 152гр
З адание
№3
адание
№3
П одставляем
данные из условия задачи.
одставляем
данные из условия задачи.
.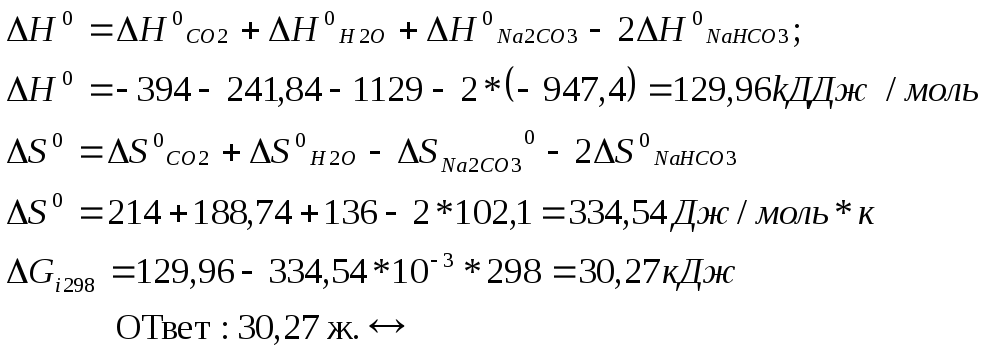
Задание №5
А+2В =3С;
Р ешение:
ешение:
И з
условия задачи изменения концентрации
происходит в отношении , выраженном
уравнением реакции.
з
условия задачи изменения концентрации
происходит в отношении , выраженном
уравнением реакции.

Задание№6
П![]() о
правилу Ле Шателье если на систему
находящуюся в равновесии оказывается
внешнее воздействие, то смещение
равновесия смещается в ту сторону при
котором ослабляется эффект внешнего
воздействия.
о
правилу Ле Шателье если на систему
находящуюся в равновесии оказывается
внешнее воздействие, то смещение
равновесия смещается в ту сторону при
котором ослабляется эффект внешнего
воздействия.
В лияние
температуры:
лияние
температуры:
А) при повышении температуры увеличивается константа равновесия. Идет смещение той реакции с поглощением теплоты
1) реакция смещается влево (в сторону образования СО)
-
вправо (образуется Н2 и S2)
Б) при понижении температуры увеличивается константа равновесия экзотермического
1) смещается в право (образуетсяСО2+С)
-
в сторону Н2S
Влияние давления:
А) При повышен Р равновесия смещается в сторону образования меньшего числа молей газообразных веществ в газовой смесей и соответственно в сторону уменьшения давления в системе.
![]() 1) Смещение в право
1) Смещение в право
![]()
![]() 2) смещение влево
2) смещение влево
Б) при понижении Р
Равновесие смещается в сторону большего числа молей ,что вызывает увеличения давления в системе.
1) смещение Влево (образование СО)
-
в право (образование Н2 + S2)
Как изменится скорость реакции при
Уменьшении концентрации системы в 3 раза?

Задание№8
При изменении внешних параметров (р1,Т) равновесие нарушается, исчезают старые появляются новые фазы. Расчет числа степеней свободы в системе в зависимости от числа компонентов от изменения внешних параметров производят с помощью правила фаз Гиббса:
С=К-Ф+2 ; К-число компонентов.
Ф-число фаз.
Если на систему действует только (t-C или Р)
Т емпература
или давление, то +1.
емпература
или давление, то +1.
Ответ: С=2.