
1 Контрольная работа / 1- 2_Химия_2
.rtf
Контрольная работа №1 по Химии
Вариант 2
Задача 1. Составить уравления получения возможных солей между гидроксидом галлия (III) и азотной кислотой. Назвать все соли и построить их графические формулы.
Ответ
Дигидроксонитрат галлия
Ga(OH)3+HNO3Ga(OH)2NO3+H2O
Гидроксонитрат галлия
Ga(OH)3+2HNO3GaOH(NO3)2+2H2O
Нитрат галлия
Ga(OH)3+3HNO3Ga(NO3)3+3H2O
Графические формулы
H
– O O 
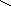
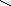
Ga(OH)2NO3
Ga – O – N 


H – O O
O

O – N 
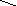

Ga(OH)(NO3)2
H – O – Ga O O
O –N 


O

O
N
– O O


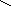
Ga(No3)3
O Ga – O – N 

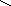
O O



N
– O 

O
Задача 2. Вычислить эквивалент и эквивалентную массу цинка, зная, что 0,584 г его вытеснили из соляной кислоты 219 мл водорода, измеренного при 17С и 740 мм рт.ст.
Ответ
Zn+2NCEZnCe2+H2
a) Приведем объем H2 к нормальным условиям, используя формулу Бойля-Марриотта и Теймассона
P0 V0 = P1 V1
T0 T 1
T 1= 273k+17=290k
б) находи мэквивалентную массу цинка
0,2л H2 вытесняется 0,584 г Zn
11.2л H 2 вытесняется Э мет/г/моль, находим
ЭмZN=(11.2*0.584)/0.2=32.7 г/моль
в) находим эквивалент цинка
Zn=Ar/B=65/2=32.5
Задача 3. Вычислить изменение энергии Гиббса G при 25С для реакции между чистыми веществами: MgCO3(T)=MgO(T)+CO2(г)
Ответ:
1)определим H0298
H0298=(H0MgO+H0CO2) - H02MgCO3
H0298=(-393.54+(-601.24)-(-1096.21)=101.46 кДж/моль
2. определим энтропию реакции:
S0298=S0MgO+S0CO2 - S0MgCO3
S0298=(29.94+213.69)-65.69=117.94 Дж/моль (117,94*10 –3кДж/моль)
3. Используя уравнение Гиббса-Гельмгольца, находим изменение энергии Гиббса:
G=H0-TS=101.46-117.94*10-3*298=101.46-298*0.11794=101.46-34.0847=67.3753 кДж/моль
так как G0, реакция является эндотермической.
Задача 4. Найти тепловой эффект реакции: CH4+CI2CH3CI+HCI
Ответ: Тепловой эффект химической реакции равен разности между суммой теплоты сгорания исходных веществ и суммой теплоты сгорания продуктов реакции.
H0x.р=H0исх.- H0прод.
Из формулы реакции находим H
H0х.р.=( H0CH4+H0CI2) – (H0CH3CI+H0HCI)
Задача 5. При синтезе COCI2 имеет место равновесие реакции CI2+CO COCI2 Определить исходные концентрации хлора и оксида углерода, если равновесные концентрации равны, моль/л CI2=2.5 CO=1.8 COCI2=3.2 и рассчитать константу равновесия.
Ответ:
Определим константу равновесия данной химической реакции:
Кс= COCI2 =3,2/(2,5*1,8)=0,7
CI2*CO
Исходные вещества и продукт реакции в данном уравнении находятся в одинаковых количествах.
1 моль COCI2 расходует 1 моль CI2
3,2 моль COCI2 расходует 3,2 моль CI2
CI2исх=2,5+3,2=5,7 моль/л
1 моль COCI2 расходует 1 моль CO
3,2 моль COCI2 расходует 3,2 моль CO
COисх=3,2+1,8=5 моль/л
Задача 6 Каково значение энергии активации реакции, скорость которой при 320К в 25 раз больше, чем при 300 К.
Решение:
1) так как изменяется только Т, то можно сделать вывод: К1*25=К2 25= К2
К1
Еакт = RT1*T2*2.3lg* К2/ К1 = 8.31*320*300*2.3*lg25 = 1834848*lg25 =
T2 – T1 320 – 300 20
Еакт =128250.4 Дж/моль
Задача 7. В керамическом производстве при различных температурах протекают реакции:
Na2 So4(T) +2C(T) +CaCO3(T) =Na2CO3(T) +CaS(T) +2CO2(T )
Fe2 O3(T) +C(T)=2FeO(T) +CO(T )
Определить в этой системе число фаз, число независимых компонентов и степеней свободы.
Решение:
Na2So4(T) + 2C(T) + CaCO3(T) Na2CO3(T) + CaST +2CO2(T)
Fe2O3(T) + C(T) 2FeO(T) + CO(T)
C = K + 2 – Ф
К = 9 – 2 = 7
Ф = 8
С = К + 2 – Ф = 7 + 2 – 8 = 1
Система одновариантна
