
1 Контрольная работа / 1- 1_Химия_2
.docКонтрольная работа № 1 по химии
Вариант № 1
Выбрал вариант №1, по формуле V=(N*k) div 100
Всего вариантов в методическом пособии – 10
Мой пароль –******11
-
Написать формулы гидроксидов, соответствующих указанным оксидам:
![]()
![]()
![]()
![]()
![]()
![]()
![]() Какими свойствами (основными, амфотерными,
кислотными) обладают приведенные оксиды
и соответствующие им гидроксиды . Назвать
и построить их графические формулы,
определить эквивалент и эквивалентную
массу для соединений:
Какими свойствами (основными, амфотерными,
кислотными) обладают приведенные оксиды
и соответствующие им гидроксиды . Назвать
и построить их графические формулы,
определить эквивалент и эквивалентную
массу для соединений:
![]()
![]()
![]()
![]()
![]()

![]() амфотерный
гидроксид берилия
амфотерный
гидроксид берилия

![]() -
кисл. хлорная кислота
-
кисл. хлорная кислота

![]() -
амфотерный мышьяковистая кислота
-
амфотерный мышьяковистая кислота

![]() -
кислота мышьяковая
-
кислота мышьяковая

![]() -
кислота серная
-
кислота серная

![]() -
гидроксид талия, только основные
свойства.
-
гидроксид талия, только основные
свойства.


-
Закончить уравнения реакций:


-
Рассчитать энтальпию образования жидкого сероуглерода
 по
следующим данным:
по
следующим данным:

По следствию из закона Гесса записываем
выражение
![]() :
:
![]()
![]()
![]()
-
Сколько нужно затратить теплоты, чтобы разложить 200 г
 до
оксида натрия и диоксида углерода, если
тепловые эффекты реакции равны:
до
оксида натрия и диоксида углерода, если
тепловые эффекты реакции равны:


-
Начальные концентрации веществ в реакции
 были равны, моль/л,
были равны, моль/л,
 Вычислите концентрации всех участвующих
в реакции веществ после того, как
прореагировало 60% воды.
Вычислите концентрации всех участвующих
в реакции веществ после того, как
прореагировало 60% воды.
0,6 моль/л – 100% х=0,36 моль/л
х моль – 60%
0,5 моль/л – 100% х=0,3 моль/л
х – 60%
![]()
-
В каком направлении сместиться равновесие в системе
 при
повышении давления (в три раза), при
повышении температуры:
при
повышении давления (в три раза), при
повышении температуры:
Написать для всех реакций выражение закона действия масс.
![]()
а) при повышении температуры равновесие сместится вправо (принцип Ле Шателье)
б) в гетерогенной системе (присутствует твердая фаза) повышение давления не имеет значения для смещения равновесия.
![]()
а) при повышении температуры равновесие сместится вправо
б) повышение давления не имеет значения
![]()
при повышении температуры и давления – равновесие сместится вправо

при увеличении давления в системе в три раза, объемы системы уменьшатся в три раза, а концентрация возрастет в три раза.
-
В стеклоплавильных печах протекают реакции:
![]()
Примените правило фаз к каждой реакции в отдельности.
1) с=к-ф+2 к=4-1=3
с=3-2+2=3 с=3
2) с=к-ф+2 к=4-1=3
с=3-2+2=3 с=3
Правило фаз: число степеней свободы (с) равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов минус число фаз, плюс два.
-
Медь и никель образуют непрерывный ряд твердых растворов. Расплав, содержащий 60% никеля, охлаждали до
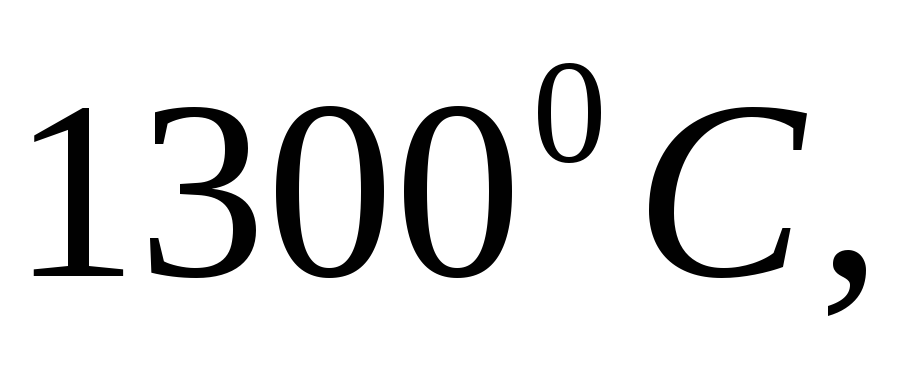 после чего жидкую фазу сливали; выпавшие
кристаллы твердого раствора расплавляли
при
после чего жидкую фазу сливали; выпавшие
кристаллы твердого раствора расплавляли
при
 и
жидкий расплав вновь охлаждали до
и
жидкий расплав вновь охлаждали до

Определите:
а) сколько выпало твердой фазы при первичном и повторном охлаждениях, если количество исходного расплава составляло 20кг.
б) какого состава получилась при этом твердая и жидкая фазы?
в) постройте кривые охлаждения для сплавов, содержащих 20, 40,60, 100% никеля.

В Т/вес (Р) расплава, содержащего 60% Ni=0,3кг. При охлаждении до 1300 градусов (Т2), выделяется чистый компонент Ni.
Равенство ар=в(р-р) можно представить
![]()
![]()
Если а=МО; в=МN то
![]()
![]() по правилу – вес выкристаллизовывающейся
части системы относительно весу всей
системы, так же как на диаграмме плечо
ON прилежащее к кривой ANB
по всей прямой MN соединяющей
точки MO.
по правилу – вес выкристаллизовывающейся
части системы относительно весу всей
системы, так же как на диаграмме плечо
ON прилежащее к кривой ANB
по всей прямой MN соединяющей
точки MO.

при Т – 1300 выделится1,5г Сu.
Диаграмма принадлежит к диаграммам с неограниченной растворимостью компонентов в тв. состоянии выделившиеся новые порции твердого раствора (Cu или Ni) по сравнению с жидким снова будут обогащаться соответственным компонентом. Состав твердого раствора в процессе кристаллизации меняется по линии солидуса. По диаграмме: диффузия в кристаллах значительна при каждой температуре, вся кристаллическая фаза приходит в равновесие с расплавом нового состава. При дальнейшем понижении температуры будет происходить охлаждение твердого раствора.
Кривые охлаждения.
1 –1 – 20%
2 – 2 – 40%
3 – 3 – 60%
4 –4 – 100%
