
1.Теория:
А.С.Егоров Химия. Репетитор, 2013:
1) §2.1- §2.4 §6.1-6.3. Обязательно- упражнения после параграфов.
2.Упражнения:
В.Н. Доронькин и др. Тренировочная тетрадь"Общая химия;" Ростов-на-Дону, Легион ,2013
1) с.82- №№ 6.1-6.24
2) с. 11 (пример 9), задачи с.15 №№ 1.2.1, 1.2.11-1.2.14, 1,2.16-1.2.18, 1.2.23, 1.2.26
Стр.118.№№ 11.2.1-11.2.15 Вопрос А28 или по новой классификации -26
3.Тесты
1. В.Н. Доронькин и др. Химия Тематические тесты. Базовый и повышенный уровень,Ростов-на- Дону, Легион , 2014:
Вопрос А7(7) только неорганические соединения ,и А9(9),А10(10).
Вопрос В5 Сделать задания, связанные со свойствами оксидов, оснований и кислот.
2.ЕГЭ. Химия Типовые экзаменационные варианты, под редакцией А.А. Кавериной 2015,:
Вопросы 6,8, и 9 (варианты с 1 по 30) и 31 Сделать задания, связанные со свойствами оксидов, оснований и кислот.
3.Электронные тесты
4.Любые другие тесты-вопрос –А7(7), А-9(9)и А(10) (Вопросы, по рассматриваемой теме)
Тесты.
Оксиды
Для успешного ответа по тестам ОКСИДЫ, надо не только знать, но и уметь:
1) отнести оксид к соответствующему типу (кислотный, основной, амфотерный, несолеобразующий), назвать его по международной и тривиальной (если таковая существует)номенклатурам и написать структурную формулу
2) оценить изменение кислотных , основных свойств оксидов или характер связей в данном ряду соединений
3) написать уравнение любой реакции, характеризующей кислотные ,или основные или амфотерные свойства данного оксида.
4) написать уравнения особых реакций,свойственных для данного оксида-это обычно ОВР; м.б. реакции термического разложения или др
5) писать уравнения реакций получения любого типа оксидов
Тест 1
1. Среди следующих веществ оксидом не является:
1) ВаO2 2) МnO2 3) РbO2 4) NO2
2. Основный оксид не может быть получен при термическом разложении:
1) Си(ОН)2, 2) КОН 3) Fe(OH)2 4) СаСО3
3. Какие из приведенных утверждений верны?
А. Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
4. Оксид углерода(IV) реагирует с каждым из двух веществ:
1) водой и оксидом кальция
2) кислородом и оксидом серы(IV)
3) сульфатом калия и гидроксидом натрия
4) фосфорной кислотой и водородом
5. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) КОН + SО3(изб)→ 1) КНSО4
Б) КОН(изб) + SО3 → 2) К2SО3
В) КОН + СО2 (нзб) → 3) К2СО3 и Н2О
Г) КОН(изб) + СО2 → 4) К2SО4 и Н2О
КНСО3
6. Только кислотные оксиды расположены в ряду:
СО2, Мn2О7, SО3 3) СгО, SО2, СаО
Nа2О,SiO2, Сг2О3 4) СuО, А12О3, FeО
7. Между собой взаимодействуют
1) SiO2и Н2О
2) СО2 и Н2SО4
3) СО2 иСа(ОН) 2
4) Nа2O и Са(ОН) 2
8. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) CO2+H2O → 1) CaCO3
Б) CO2+CaO → 2) CaCO3+H2O
В) CO2(избыток) + Са(ОН) 2(2:1)
Г) CO2+ Са(ОН) 2(1:1)
3) Ca(HCO3) 2
4) CO+H2
5) H2CO3
6)Са (НСО3)2 + Н2О
11 |
22 |
33 |
Г4 |
|
|
|
|
9. Оксид серы (VI) реагирует с каждым из двух веществ:
водой и гидроксидом кал.ия
кислородом и оксидом серы(IV)
нитратом натрия и гидроксидом натрия
фосфорной кислотой и водородом
10. Вещество, которое может реагировать с водородом, серной кислотой и алюминием,
имеет формулу
1) Р2О5 2) СиО 3) Ва(NО3)2 4) К2О
Тест 2
1. Оксид серы(IV) не взаимодействует с
1) О2
2) Н2О
3) СО2
4) NаОН
2. Кислотным и основным оксидом являются соответственно
1) SО2 и MgО 3) Na2O и FеО
2) СО2 и А12О3 4) ZnО и SО3
3. Оксид хрома (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) оксид кальция и гидроксид натрия
4) вода и медь
4. Кислотным и основным оксидом являются соответственно
1) SО2 и FеО
2) СО2 и А12О3
3) МnО и Nа2О
4) ZnО и SО3
5. Оксид серы(IV) проявляет свойства
1) основного оксида
2) амфотерного оксида
3) кислотного оксида
4) несолеобразующего оксида
6. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А)Al2O3+NaOH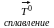 1)NaAlO2
1)NaAlO2
Б)Al2O3+NaOH+H2O→ 2) NaAlO2+H2O В)Al2O3+Na2CO3 3) NaAlO2+CO2
Г)Al2O3+HCl→ 4) Na[Al(OH)4]
5) AlCl3+H2O
6) AlCl3+H2
А |
Б |
В |
Г |
2 |
4 |
3 |
5 |
7. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А)P2O3+H2O→ 1)H3PO2
Б)P2O5+H2O→ 2) H3PO3
В)P2O5+MgO→ 3) H3PO4
Г)P2O5+Mg(OH)2→ 4) Mg3(PO4)2
5) Mg3(PO4)2+H2
6) Mg3(PO4)2+H2O
8. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) SO2+H2O 1) CaSO3+H2
Б) SO3+H2O 2) CaSO3+H2O
В) SO2+Ca(OH)2 3) CaSO4+H2
Г) SO3+Ca(OH)2 4) CaSO4+H2O
5) H2SO3
6) H2SO4
9. Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
НАЗВАНИЕ ОКСИДА ВЕЩЕСТВА
А)оксид кремния (IV) 1) Al,HNO3,CO Б)оксид азота(IV) 2) FeO,CO2,H2O В)оксид бария 3) C, KOH,CaCO3 Г)оксид железа(III) 4)NaOH,H2O, CaO
5) H2O,SO3, H3PO4
6) H2O, HNO3, Ca(OH)2
А |
Б |
В |
Г |
3 |
|
|
|
10. К амфотерным оксидам относится
1) CrO3 2) SО3 3) СО2 4) Сг2О3
Тест 3
1. Число соединений из указанных (H2O, H2SO4, P2O5, Na2O, КОН, SiO2), с которыми взаимодействует оксид азота (V), равно:
1) 6 2) 5 3) 4 4) 3
2. Соль образуется, когда с соляной кислотой реагируют: 1) CO2
2) CaO
3) SO2
4) Al2O3
3. Укажите формулы веществ, при взаимодействии которых с Mn2O7 образуется соль:
1) K2O 2) HNO3 3) NaOH 4) H2O
4. Соль образуется, когда оксид хрома (VI) реагирует с:
1) H2O 2) NaOH 3) H2SO4 4) CaO
5. Основные свойства могут проявлять оксиды:
I) SO2 2) Al2O3 3) CaO 4) P2O5
6. С водой при 200C обратимо взаимодействуют оксиды:
1) P2O5 2) CO2 3) SO2 4) SO3
7. Соль образуется, когда оксид кальция реагирует с:
1) водой 2) оксидом серы (VI) 3) оксидом калия 4) фосфорной кислотой
8. Кислота образуется, когда с водой по отдельности реагируют все оксиды ряда (20°С):
1) SO3 , P2O5 , Mn2O7 , CrO3
2) N2O5 , SO2 , SO3 , ZnO
3) CO2 P2O5, N2O, SiO2
4) SO3 , CrO3, K2O, Al2O3
9. Основный характер оксида меди (II) показывают схемы реакций:
l) CuO→ Cu2O+ O2
2) CuO + HCl → CuCl2 + H2O
3) CuO + SO3 → CuSO4
4) CuO + H2 → Cu + H2O
10. Кислотный характер оксида кремния (IV) показывают схемы реакций:
I) SiO2 + С → Si + СО
2) SiO2+ K2O → K2SiO3
3) SiO2 + NaOH → Na2SiO3 + H2O
4) SiO2+ Mg →Si + MgO
Основания
Для успешного ответа по тестам основания (гидроксиды), надо не только знать, но и уметь:
1) отнести основание к соответствующему типу –типичное основание или амфотерное , назвать его по международной и тривиальной (если таковая существует)номенклатурам и написать структурную формулу
2) написать уравнение любой реакции, характеризующей химические свойства оснований и амфотерных гидроксидов.
3) написать уравнения реакций получения растворимых и нерастворимых оснований
знать 4) разницу в химических реакциях растворимых и нерастворимых оснований
Тест1
.1 Основания – это сложные вещества, при диссоциации которых образуются
1) ионы водорода и кислотных остатков
2) ионы металлов и кислотных остатков
3) ионы металлов или аммония и гидроксид –ионы
4) катионы аммония и анионы кислот
2.Для получения щелочей в технике обычно используют
1) гидролиз солей щелочных металлов
2) термическое разложение солей щелочных металлов
3) электролиз водных растворов хлоридов щелочных металлов
4) взаимодействие щелочных и щелочно-земельных металлов или их оксидов с водой
3.Основания делят на 2 группы
1) растворимые и нерастворимые
2) одноосновные и двухосновные
3) взаимодействующие с кислотами и не взаимодействующие с ними
4) гидроксиды металлов и гидроксиды неметаллов
4. Растворимые основания – это сильные электролиты.Единственное исключение-это
1) LiOH
2) NH4OH
3) CsOH
4) NaOH
5. В ряду Be(OH)2 - Mg(OH)2 - Ca(OH)2 - Sr(OH)2 - Ba(OH)2 растворимость в воде и их сила
1) уменьшается 2) увеличивается 3) не изменяется 4) все эти основания - нерастворимы
6. Число гидроксидов среди перечисленных веществ HNO3, NaOH, CuSO4, CO2, KCl, H3PO4, Ba(OH)2 , Zn(OH)2, H2SO4
1) 3 2) 4 3) 5 4) 6
7. Свойства гидроксидов s-металлов II группы с увеличением заряда ядра атомов изменяются в следующей последовательности
1) щелочь – нерастворимое основание – амфотерный гидроксид
2) амфотерный гидроксид– нерастворимое основание– щелочь
3) кислота – амфотерный гидроксид– щелочь
4) основание –амфотерный гидроксид– кислота
8. Раствор гидроксида калия реагирует с каждым из веществ группы
1) оксид кремния, фосфат натрия, бром, гидроксид цинка
2) оксид меди(II), железо, азотная кислота, гидроксид цинка.
3) оксид кремния, гидроксид цинка, алюминий, азотная кислота
4) оксид меди(II), железо,аммиак, гидроксид цинка
9. При нагревании гидроксида меди (II) образуются
1) Cu и H2O 2) CuO и H2 3) CuO и H2O 4) Cu2O и H2O
10.Амфотерные свойства проявляют
1) Ba(OH)2
2) Zn(OH)2,
3) Be(OH)2
4) Mg(OH)2
5) Cr(OH)3
6) Sn(OH)2 . Ответ:____ Ответ запишите цифрами без пробелов
Тест2
1.Гидроксид меди (II) можно получить при взаимодействии:
I) Cu и Н2O
2) CuO и Н2O
3) CuCl2 и KOH (р-р)
4) Cu и KOH (р-р)
2.Гидроксид кальция не взаимодействует с
1) HCl 2) CO2 3) CuS 4) HNO3
3. Гидроксид натрия взаимодействует с
1) SO3 2) Na2O 3) Mg(OH)2 4) N2O
4. Раствор гидроксида лития реагирует с каждым из веществ, указанных попарно
хлоридом железа (III) и углекислым газом
оксидом железа (II) и азотной кислотой
серной кислотой и карбонатом кальция
оксидом алюминия и хлоридом калия
5. Гидроксид железа (III) взаимодействует с каждым из двух веществ
1) KOH и H2SO4
2) Cu(OH)2 и HCI
3) HNO3 и Na2SO4
4) HCl и BaCl2
6. Гидроксид хрома (III) взаимодействует с каждым из двух веществ: 1) СО2 и HCl 2) SiО2 и Cu(OH)2 3) NО и NaNO3 4) H2SO4 и NaOH
7. Амфотерными являются все гидроксиды в ряду
1) Ba(OH)2 , Zn(OH)2, Cr(OH)3
2) Аl(OH)3 , Cr(OH)3, Fe(OH)3
3) NH4OH, Pb(OH)2 , Аl(OH)3
4) Cr(OH)3 ,Sn(OH)2, Ca(OH)2
8. Гидроксид алюминия взаимодействует с каждым из двух веществ
1) HCl и Zn
2) HCl и NaOH
3) CO иH2S
4) BaCI2 и Ca(OH)2
9. Реакция нейтрализации происходит между
1) алюминием и серной кислотой(разбавленной)
2) серной кислотой и нитратом бария
3) серной кислотой и гидроксидом меди (II)
4) гидроксидом бария и хлоридом меди (II)
10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А)Al(OH)3+RbOH(водный раствор) 1)NaAlO2
Б) Al(OH)3+NaOH → 2) NaAlO2+H2O В) Al(OH)3+Na2CO3 3) NaAlO2+CO2
Г) Al(OH)3+HCl→ 4) Na[Al(OH)4]
5) AlCl3+H2O
6) Rb[Al(OH)4]
Ответ запишите цифрами без пробелов
Тест 3
1. Щелочь образуется при взаимодействии:
1) FeCl2 и NaOH (р-р)
2) NaNO3 и Ca(OH) 2 (р-р)
3) BaH2 и H2O
4) CaO и Н2O
2.Гидроксид железа (II) можно получить при взаимодействии:
I) Fe и Н2O
2) FeO и Н2O
3) FeCl2 и NaOH (р-р)
4) Fe и KOH (р-р )
3.Укажите формулы веществ, с которыми в водном растворе реагирует Cu(OH)2:
1) HNO3
2) HCl
3) NaOH (разб.)
4) K2SO4
4. Сколько веществ из указанных CaO, BeO, N2O5, CuSO4, Na2SiO3 реагируют
с KOH (р-р)?
1) 5
2) 4
3) 3
4) 2
5. Химическое взаимодействие возможно между: 1) KOH и SiO2
2) Al2O3 и NaOH 3) Fe(OH)2 и K2SO4 (р-р)
4) Ca(OH)2 (р-р) и P2O5
6. Гидроксид цинка в водном растворе реагирует с:
1) CuSO4
2) CaCl2
3) Ba(ОН)2
4) H2SO4
7. С гидроксидом натрия в водном растворе реагирует каждое из веществ в рядах:
1) ) N2O5 , H2SO4 , Cr2O3
2) Al2O3 , SO2, FeSO4
3) Al2O3 , Na2CO3, SО3
4 )Al , Al(OH)3 , CuCl2
8. Гидроксид алюминия может образоваться при взаимодействии:
1) А12O3 и Н2O
2) Al2(SO4)3 и NH4 OН (избыток)(NH3 ∙Н2O)
3) AlCl3 и NaOH (избыток)
4) А12O3 и KOH (р-р)
9. Кислотные свойства Be(OH)2 проявляет, реагируя с: 1) HCl
2) H2SO4
3) NaOH
4) Ba(OH) 2
10. Основные свойства Cr(OH)3 проявляет, реагируя с водными растворами:
1) HNO3
2) КОН
3) HCl
4) NaOH
Кислоты
Тест 1
1. Формулы только слабых кислот приведены в ряду:
1) H2SO4 , HClO4 , HNO3
2) CH3COOH , H2CO3 , H2S
3) HCl , HBr, HF
4) HI , HF, H2S
2. Формулы только сильных кислот приведены в ряду:
1) HF, HCl , HNO3
2) HCl , HNO3 , H2SO4
3) H3PO4 , HClO4 , HCl
4) H2SO3 , H2SO4 , CH3COOH
3. Формулы только ортокислот приведены в ряду:
1) H3SbO4 HSbO3, , H3SbO3
2) HCl , HNO3 , H2SO4
3) H3PO4 , H3AsO4 , H3PO3
4) H2SO3 , H3BO3 , CH3COOH
4. Формулы только дикислот (пиро)приведены в ряду:
1) H4P2O7, H2Сr2O7, , H2S2O7,
2) HCl , HNO3 , H2SO4
3) H3PO4 , H3AlO3 , H2CrO4
4) H4SiO4 , H2SiO3 , H3SbO4
5. Формулы кислот, которые могут образовывать кислые соли:
1) H2S
2) CH3COOH
3) H3PO4
4) H2SO3
6. Нитрат образуется, когда разбавленная азотная кислота реагирует с:
1) CO2
2) Cu(OH)2
3) NaCl
4) Al2O3
7. Заряд каких кислотных остатков равен 1-:
1) гидросульфид-ион
2) гидрофосфат-ион
3) гидросульфит-ион
4) гидросульфат-ион
8. Непосредственным взаимодействием воды и кислотного оксида можно получить кислоты:
1) серную
2) фосфорную
3) кремниевую
4) соляную
9.Кислота образуется при взаимодействии
1) SiO2 и Н2O
2) АgNO3 (разб.) и Н3РО04(разб.)
3) BaCl2 и HNO3 (разб.)
4) NO и H2O
10.Газ выделяется, когда между собой реагируют
I) KCl (т) и Н2SO4 (конц.)
2) K2CO3 и CH3COOH
3) CaSO3 и HCl (конц.)
4) KCl (т) и HNO3 (разб.)
Тест 2
1..При растворении в холодной воде оксида азота (Ш) образуется:
1) HNO3
2) HNO2
3) смесь HNO3 и HNO2
4) смесь HNO2 и NО
2. Кислотные свойства наиболее ярко выражены у вещества ,формула которого
1) NН3
2) H2S
3) Н2SO4
4) HF
3. Формула самой слабой кислоты
1) HBr
2) HBrO4
3) Н2SO4
4) НOCl
4. В ряду кислот НClО- НClО2- НClО3- НClО4- окислительная активность
1) увеличивается
2) не изменяется
3) уменьшается
4) увеличивается незначительно
5. Самой сильной кислотой является:
1) HNO2
2) HNO3
3) НCl
4) НClО4
6. В каком из вариантов формулы кислот перечислены в последовательности:
хлорная- пирофосфорная – метафосфорная - стеариновая
1) НClО- Н2S2O3 - H3PO4 - C17H35COOH
2) НClО4- H4P2O7- HPO3 - C17H35COOH
3) НClО2- H3PO4- H4P2O7-C17H35COOH
4) НClО- H4P2O7- HPO3-CH3COOH
7. Какую окраску приобретает индикатор в кислой и щелочной среде соответственно:
1) красный,желтый
2) синий,красный
3)фиолетовый , бесцветный
4) желтый, красный
8. Какова окраска лакмуса в растворе, полученном при смешивании 4,0 г азотной кислоты 4,0 г гидроксида натрия
1) красный,
2) синий,
3) фиолетовый
4) желтый
9. Соляная кислота реагирует с каждым из двух веществ
1) Zn и Ca(OH)2
2) Ag и Au
3) KOH и CO2
4) NaOH и Ag
10. Верны ли следующие суждения о свой ствах угольной кислоты
А.Угольная кислота- сильный электролит
Б Угольная кислота образует кислые и средние соли
1) верно только А
2) верно только Б
3) верны оба суждения
4)неверны оба суждения
Тест 3
1. Соляная кислота взаимодействует при обычных условиях со всеми веществами набора:
1) KHCО3, Ва, Fe(OH)3
2) Li2О, Сu, Pb(NО3)2 (р-р)
3) ZnO, KNO3 (р-р), Fe
4) СО2, AgNO3 (р-р), Mg
2. Вещества, с которыми может взаимодействовать как соляная кислота, так и водный раствор гидроксида калия, — это:
1) Zn, СO2, Ве(ОН)2
2) КНСO3, CH3COONH4, А12O3
3) Zn(OH)2, Al, CuBr,
4) Са(НСОэ)2, Си, Сг2O3
3. Хлорноватая кислота является гидратом:
1) оксида хлора (I)
2) оксида хлора (III
3) оксида хлора (V)
4) оксида хлора (VII)
4. Дихромовая кислота, гидроксид свинца (II) и азотистая кислота являются гидратами соответственно следующих оксидов:
1) Сr2O3, РbО, NO2
2) СrO3, РbО, N2O5
3) СrO3, РbO2, N2O3
4) СrO3, РbО, N2O3
5. Соляная кислота взаимодействует при обычных условиях со всеми веществами набора:
а) CaCО3, Mg, Al(OH)3
в) K2О, Ag, Pb(NО3)2
б) SnO, LiNO3, Al
г) SО2, AgNO3, Mn
6. И разбавленная серная кислота, и разбавленный водный раствор гидроксида калия взаимодействуют с каждым из веществ набора:
1) гидроксид меди (II), гидроксид цинка, оксид алюминия
2) хлорид бария, цинк, гидроксид алюминия
3) хлорид аммония, гидроксид хрома (III), оксид углерода (IV)
4) алюминий, оксид цинка, гидрокарбонат калия
7. Все три вещества — хлорид алюминия, уксусная кислота и гидроксид калия — реагируют с: 1) AgNO3 2) НВr 3)СаСO3 4) (NH4)2CO3
8. Формулы кислоты, нормальной соли и амфотерного гидроксида соответственно:
1) NH3, CaSO4, А1(ОН)3
2) HBr, A12(SO4)3, Zn(OH)2
3) HNO3, NH4C1, Ва(ОН)2
4) H2SO4, KHCO3, Cr(OH)3
9.Формулы щелочи, основной соли и двухосновной кислоты соответственно:
1) Ва(ОН)2, А1(ОН)2С1, H2S
2) NaHCO3, A12(SO4)3, H3PO4
3) КОН, NaCl, Н2СO3
4) KOH, KHCO3, H2SO3
10. Гидроксид цинка, гипохлорит натрия, гидрокарбонат кальция — это соответственно:
1) основание, кислая соль, основная соль
2) амфотерный гидроксид, нормальная соль, кислая соль
3) амфотерный гидроксид, основная соль, кислая соль
4) основание, нормальная соль, основная соль
Материалы к занятию № 6
Амфотерные гидроксиды.Соли: средние,кислые,основные.
Взаимосвязь неорганических соединений («цепочки»).
Задачи с участием газов. "Избыток-недостаток".
Домашнее задание:
