
Курсовая по органике
.docx
МИНИСТЕРСТВО
СЕЛЬСКОГО ХОЗЯЙСТВА
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ –
МСХА имени К.А.Тимирязева»
(ФГБОУ ВО РГАУ – МСХА имени К.А.Тимирязева)
Кафедра физической и органической химии
Курсовая работа
по дисциплине: Органическая химия
на тему: «Идентификация неизвестного органического соединения»
Выполнила:
студентка 1 курса
факультета ПАЭ 101 гр.
Проверил:
Пржевальский Н. М.
Москва 2015
СОДЕРЖАНИЕ
1).Введение…………………………………………………………………...3
2).Физико-химические свойства…………………………………………….4
3).Качественные реакции………………………………….………………....5
4).Анализ спектров…………………………………………………….…......8
5).Получение……………………………………………...…………………...9
6).Применение…………..…………………………………………………...10
7).Заключение………………………………………………………………..11
8).Список использованной литературы…………………………………….12
ВВВЕДЕНИЕ
Целью данной курсовой работы является закрепление теоретических знаний и практических навыков самостоятельного решения задач по очистке и идентификации неизвестного органического соединения. Нужно узнать, к какому классу относиться данное соединение и точно определить его.
Если твердое вещество растворимо в воде, то для разделения смеси можно применить метод выпаривания. Выпаривание- выделение растворенных в жидкости твердых веществ способом ее превращения в пар.
Для разделения жидкостей растворимых друг в друге, получения чистой (без примесей) воды используют метод дистилляции (или перегонки). Дистилляция- перегонка, разделение содержащихся в жидких смесях веществ по температурам кипения с последующим охлаждением пара.
Чтобы разделить две не смешивающиеся жидкости (нефть и вода, подсолнечное масло и вода), нужно воспользоваться делительной воронкой. Жидкость с большей плотностью сольется в стакан, а в делительной воронке останется более легкая жидкость.
Характерными константами жидкого органического вещества является температура плавления (т. кип.), показатель преломления света (nD) и плотность (d). Чистое вещество кипит в пределах 1-2оС и не изменяет показателя преломления и плотности при повторных перегонках.
Идентификацию соединений проводят путём установления идентичности констант ( tпл, tкип, Rf и др.) как самого определяемого соединения, так и его производных с константами заведомо известных веществ. Исследования проводят в такой последовательности:
-
Изучают физические свойства соединения (агрегатное соединение, цвет, запах, tпл и tкип );
-
Определяем качественный состав, т.е. делаем пробы на присутствие углерода, водорода, азота, галогенов, серы.
-
Устанавливаем класс анализируемого вещества.
-
Подтверждаем структуру соединения, записав УФ-, ИК- и ПМР-спектры вещества.
-
Результаты всех исследований оформляем как курсовую работу.
ФИЗИКО - ХИМИЧЕСКИЕ СВОЙСТВА ИССЛЕДУЕМОГО ВЕЩЕСТВА
Физические свойства:
Агрегатное состояние – жидкое вещество;
Цвет – бесцветное;
Запах – резкий, маслянистый.
Константы:
Ткип =128-130оС
Н2О NaOH Раствор NaHCO3 HCl (к) H2SO4
(к) C2H5OH CH3COOH Петролейный
эфир C6H6 При
комнатной температуре Нет Нет Нет Нет Да Да Да Нет Нет При
нагревании Плохо Плохо Плохо Плохо Плохо Хорошо Хорошо Хорошо Хорошо
Реактив Реакция Заключение 1)
Перманганат калия Не
реагирует Отсутствуют
кратные связи 2)
Соляная кислота (реактив Лукаса) Не
реагирует Отсутствует
группа –ОН 3)
Нитрование Не
взаимодействует Отсутствует
ароматическое кольцо 4)
Фуксинсернистая кислота Ярко-фиолетовое
окрашивание Есть
альдегидная группа –C=O 5)
2,4-Динитрофенилгидразин 6)
реакция Эрлиха Выпадает
осадок
Не реагирует Есть
кетонная группа
Отсутствует
NH2-группа
КАЧЕСТВЕННЫЕ РЕАКЦИИ:
1) Кратная связь - Реакция с бромом
Подавляющее большинство соединений, содержащих кратную связь (двойную, тройную или их комбинации, за исключением ароматических систем) легко присоединяют бром:
Реакцию обычно проводят в уксусной кислоте или четыреххлористом углероде. К раствору 0,1 г или 0,1 мл вещества в 2-3 мл ледяной уксусной кислоты, помещенному в маленькую пробирку, добавляют по каплям, встряхивая, 1%-ный раствор брома в ледяной уксусной кислоте.
2) Гидроксильная группы – Реакция с соляной кислотой (реактив Лукаса)
К 1 мл анализируемого вещества прибавляют 6 мл реактива Лукаса. Пробирку закрывают, встряхивают и на 10 минут оставляют стоять. Первичные спирты образуют гомогенный раствор, который окрашивается в темные тона, но остается прозрачным .9реакция не идет). Воричные дают растворы, которые в первые 10 минут мутнеют, выделяют капельки галогенпроизводного. Третичные спирты в первые 5 минут образуют хлористый алкил в виде несмешивающегося с водой и оседдающего на дно слоя.
3) Ароматические соединения – Реакция нитрование
К 0,1 мл вещества добавляют, непрерывно встряхивая, 3 мл нитрующей смеси. Смесь нагревают 5 минут на водяной бане при 45-50°С и выливают на 10 г имельченного льда. Если выпадает твердое вещество или образуется нерастворимое в воде масло желтого цвета, то можно предположить наличие ароматической системы.
4) Открытие альдегидов и кетонов- Реакция с фуксинсернистой кислотой К 1 мл свежеприготовленного раствора фуксинсернистой кислоты прибавляют каплю исследуемого вещества и встряхивают. При наличие в исследуемом веществе альдегидной группы через несколько минут появляется интенсивная розово-фиолетовая окраска. Некоторые кетоны дают бледно-розовое окрашивание.
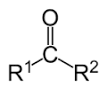

5)
Альдегиды и кетоны- 2,4-динитрофенилгидразон
В
пробирку наливают 2 мл 10%-го раствора
2,4-динитрофенилгидразина в 20%-й хлорной
кислоте и добавляют 6 мл воды. Встряхивая,
прибавляют 1 мл 10-20%-го спиртового раствора
карбонильного соединения и оставляют
стоять. Выпавший осадок подтверждает
наличие альдегидной группы. Механизм
реакции 2,4-динитрофенилгидразина с
карбонильной группой
Механизм
реакции 2,4-динитрофенилгидразина с
карбонильной группой
6) Амины и аминокислоты- Реакция Эрлиха Каплю насыщенного бензольного раствора n-диметиламинобензальдегида помещают на полоску фильтровальной бумаги. Наносят каплю эфирного раствора исследуемого вещества и помещают бумагу в сушильный шкаф (100°С) на 3-4 минуты. При положительной реакции появляется желто-оранжевое пятно.
БЛИЗКИЕ ПО КОНСТАНТАМ КИСЛОТЫ:
|
Возможные соединения |
Ткип.,оС |
Температура плавления производных оС |
|
|
фенилуретаны |
23,5-динитро- |
||
|
бензоаты |
|||
|
Этиленхлоргидрин |
129 |
51 |
92 |
|
Изоамиловый спирт |
130 |
57 |
62 |
|
|
|
семикарбазоны |
2,4-динитрофенилгидразоны |
|
Метилбутилкетон |
129 |
125 |
108 |
|
Окись мезитила |
130 |
164 |
203 |
|
|
|
бензамиды |
n-толуолсульфамиды |
|
Морфолин |
130 |
75 |
147 |
|
n-Гексиламин |
130 |
40 |
_ |
|
|
|
тозилаты |
йодметилаты |
|
альфа-Пиколин |
129 |
150 |
230 |
АНАЛИЗ СПЕКТРОВ ИСПОЛЬЗУЕМОГО ОБРАЗЦА
В ПМР-спектре исследуемого вещества можем наблюдать два основные типа- это 2,30; 2,00; В область химических сдвигов протонов 2,30 включается CH3-C=O-, смотрим далее в область 2,00 в нее входят СН3-С-Hal связи и CH3-C=O-. Из этого можно сделать вывод, что исследуемое вещество имеет структуру СН3-С(Hal)=О Из пиков 1416,39; 1386,41; 1386,44; 1387,47; 1380,04 можно понять, что в исследуемом веществе находятся пять молекул углерода с различными связями. А так как мы узнали, что исследуемое вещество имеет структуру СН3-С(Hal)=О, то делаем вывод, что из этих пяти молекул углерода четыре приходятся на Hal. Следовательно Hal- С4Н9 (бутил). ИК-спектры предельных углеводородов содержат полосы поглощения, связанные с колебаниями С-С и С-Н связей. Полосы углеводородов, связанные характеристическими частотами С-Н, находятся в трех областях: 3000-2800, 1400-1300 и около 700 см^-1. Область поглощения 1370см^-1 говорит о наличие связи С-С в исследуемом веществе. Область поглощения 700-1200см^-1, называемая так же областью «отпечатков пальцев», является наиболее трудной для идентификации полос. Однако каждое сосединение в этой области имеет свое индивидуальное поглощение, которое сильно меняется даже при небольших различиях в строении молекулы. На моем графике область поглощения 700-1200см^-1 относится к СН3-группам.
Спектры всех типов карбонильных соединений характеризуются интенсивным поглощением в области 1900-1580см^-1, обусловленный характеристическими колебаниями группы С=О. В алифатических альдегидах поглощение С=О группы наблюдается в интервале 1745-1720см^-1, в насыщенных кетонах частота С=О группы снижается до 1725-1705см^-1. На моем графике поглощение в области 1710см^-1 и это означает, что исследуемое вещество-кетон.
В ходе анализа спкктроскопии мы убедились в строение неизвестного идентифицируемого вещества: метилбутилкетон. ПОЛУЧЕНИЕ МЕТИЛБУТИЛКЕТОНА 1. Окисление спиртов Кетоны могут быть получены окислением спиртов, причем при окисление вторичных спиртов. Окислителем в лабораториях обычно является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются перманганаты различных металлов или перекись марганца и серная кислота.
2. Дегидрирование спиртов При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом, металлической медью (Cu,соединения Ag, Cr или Zn) вторичные спирты распадаются на кетон и водород. Несколько хуже эта реакция проходит в присутсвие никеля, железа или цинка.
3. Гидратация алкинов (реакция Кучерова)
ПРИМЕНЕНИЕ МЕТИЛБУТИЛКЕТОНА
1. В качестве среды для титрования органических оснований
Отрицательным моментом применения метилбутилкетона в качестве среды для титрования органических оснований является то, что в процессе титрования в ряде случаев образуются осадки, что не дает возможности быстро достигнуть равновесных потенциалов.
2. Кетоны нефти Кетоны присутствуют в нефтях в ничтожных количествах. В газовых конденсатах найдены различные метилкетоны - от ацетона до метилбутилкетона. 3. Растворитель. Как растворитель лаков и красок.
ЗАКЛЮЧЕНИЕ
В ходе проделанной работы по идентификации неизвестного органического вещества, где были проведены качественные реакции, анализ спектров данного вещества, было установлено вещество, являющееся кетоном и это метилбутилкетон СН3-С(С4Н9)=О
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
-
Грандберг И.И. Практические работы и семинарские занятия по органической химии: Пособие для студ. вузов. – М.: Дрофа, 2001. – 139с.
-
Грандберг И.И. Органическая химия. – М.: Дрофа, 2001. – 330с.
