
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объёму вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 Классы веществ и химическая связь
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №4 определение теплоВого эффекТа химичесКого процесСа
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №5 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Контрольные вопросы.
- •Лабораторная работа № 7
- •Методика выполнения работы
- •Лабораторная работа № 14 Жесткость воды и способы ее устранения
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 8 окислительно-восстановительные реакции
- •Методика выполнения работы
- •Контрольные вопросы
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
Национальный исследовательский ядерный университет «МИФИ»
Волгодонский инженерно-технический институт – филиал НИЯУ МИФИ
Методические указания для выполнения лабораторных работ
по химии
Волгодонск 2014
Содержание
Общие правила работы в лаборатории |
3 |
Правила оформления отчета о лабораторных работах |
4 |
Лабораторная работа 1. Определение эквивалентной массы металла по объему вытесненного водорода. |
5 |
Лабораторная работа 2. Зависимость свойств элементов от положения в периодической системе Д.И.Менделеева |
7 |
Лабораторная работа 3. Классы соединений и химическая связь |
8 |
Лабораторная работа 4. Определение теплового эффекта химического процесса |
9 |
Лабораторная работа 5. Скорость химических реакций и химическое равновесие |
11 |
Лабораторная работа 6. Водородный показатель среды. Гидролиз солей |
14 |
Лабораторная работа 7.Жесткость воды и способы ее устранения |
15 |
Лабораторная работа 8. Окислительно-восстановительные реакции |
16 |
Лабораторная работа 9.Органические вещества |
18 |
ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ
Каждый студент, работающий в химической лаборатории, должен строго соблюдать следующие правила работы:
1. Перед каждой лабораторной работой изучить относящийся к ней теоретический материал.
2. Проводить опыты только после внимательного прочтения полного описания работы и уяснения техники её выполнения.
3. Приступать к работам в химической лаборатории только после изучения правил по технике безопасности, получения инструктажа от преподавателя и росписи в журнале по технике безопасности.
4. Все лабораторные работы выполнять индивидуально или группами по 2-3 человека.
5. Не расходовать реактивов больше требуемого количества, это даёт экономию реактивов и времени.
6. Неизрасходованные или взятые в избытке реактивы нельзя выливать в склянки, их надо сдавать лаборанту.
7. Не загромождать рабочее место. Запрещается класть на стол портфели, книги, свёртки, тубусы и т.п.
8. Не уносить приборы, аппараты, реактивы общего пользования на своё рабочее место. Принять за правило: каждый предмет или реактив ставить на своё место немедленно после использования.
9. Концентрированные кислоты, щёлочи, отработанную хромовую смесь ни в коем случае не выливать в раковину, а выливать их в специально отведённые стеклянные банки под тягой. Бумагу и отходы твёрдых веществ, бросать в урны или в банки.
10. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щёлочи и не выносить их на рабочее место.
11. Не путать пробки от склянок и пипетки для взятия реактивов.
12. Соблюдать в лаборатории тишину. Во время работы не разговаривать с соседом.
13. Горячие приборы и сосуды ставить только на специальные подставки, а не прямо на стол.
14. По окончании работ вымыть химическую посуду, тщательно убрать рабочее место, выключить воду, электричество и газ.
15. Всегда вести запись проведённых работ. Пока выполненный опыт не записан, не переходить к следующему.
Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объёму вытесненного водорода
Ц е л ь р а б о т ы: Ознакомиться с методикой определения и расчёта молярной массы эквивалента металлов.
О б о р у д о в а н и е и м а т е р и а л ы: штатив, две бюретки на 50 см3, пробирка с газоотводной трубкой, термометр, барометр, аналитические весы и разновесы; навеска металла около 0,01 г; 2,5 М раствор НС1.
Методика выполнения работы
По объёму вытесненного водорода можно определить молярные массы эквивалентов активных металлов (магния, алюминия, цинка и т.д.), способных вытеснять водород из разбавленных кислот.
Прибор для определения молярной массы эквивалента металлов изображён на рис. 1.1. и состоит из:

2) реакционной пробирки;
3) газоотводной трубки;
4) штатива.
Налить в пробирку 4-5 см3 2,5 М раствора хлористоводородной кислоты, 5 капель раствора Со(NO3)2 – катализатора. Навеску металла количественно перенести в пробирку c кислотой, которую плотно присоединить к прибору. Тотчас начинается выделение водорода и вода вытесняется из правой бюретки в левую. Пока идёт реакция, записать показания барометра и термометра; по табл. 1 определить давление насыщенных паров воды.Когда весь металл растворится, прекратится понижение уровня воды в бюретке. Окончательный точный отсчёт показаний бюретки производится после охлаждения пробирки до комнатной температуры (через 3-5мин.).
Результаты измерений записывают по форме:
Масса металла, m=..., г
Показания бюретки до проведения реакции V1=..., см3
Показания бюретки после реакции V2=..., см3
Объём выделившегося водорода VH2 =V2 – V1=..., см3
Температура окружающей среды t=..., ° С; Т=273 +t= ..., К
Атмосферное давление Р=..., Па
Давление
насыщенных паров воды
 = ...,
Па
= ...,
Па
Парциальное
давление водорода
 =
=
 -
=
..., Па
-
=
..., Па
Объём выделившегося водорода приводят к нормальным условиям на основании уравнения состояния идеального газа, объединяющего законы Бойля-Мариотта и Гей-Люссака:

где
P0
-
нормальное
давление, равное 101325 Па; Vo
- объём газа при нормальных условиях,
см3;
То - 273 К;
-
парциальное давление сухого водорода;
 -
объём газа в условиях опыта; Т - температура
опыта по абсолютной шкале температур.
-
объём газа в условиях опыта; Т - температура
опыта по абсолютной шкале температур.
Таким образом, объём водорода, приведённый к нормальным условиям, определяется по уравнению:
 ;
;
По закону эквивалентов в случае, когда одно из реагирующих веществ находится в твёрдом состоянии, а второе - в газообразном, молярная масса эквивалента металла определяется по формуле:

где
m
- масса металла; МЭоп
- молярная масса эквивалента металла;
Vo
-объём газа, приведённый к нормальным
условиям; Vэ
- молярный
объём эквивалента газа.
Молярный
объём эквивалента водорода, составляющий
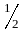 объёма его моля, занимает при нормальных
условиях 11200 см3/моль.
объёма его моля, занимает при нормальных
условиях 11200 см3/моль.
Таблица 1.
Давление насыщенного водяного пара в равновесии с водой

Затем студенты вычисляют теоретическую величину молярной массы эквивалента металла и находят относительную ошибку определения:

В конце работы записываются выводы.
Контрольные вопросы.
1. Что называется молярной массой эквивалента элемента? В каких единицах измеряется молярная масса эквивалента?
2.. Сформулируйте закон эквивалентов. Выразите его математически.
3. Какие факторы оказывают влияние на точность определения молярной массы эквивалента металла при взаимодействии его с кислотой?
ЛАБОРАТОРНАЯ РАБОТА №2
ЗАВИСИМОСТЬ СВОЙСТВ ЭЛЕМЕНТОВ ОТ ИХ ПОЛОЖЕНИЯ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА
Ц е л ь р а б о т ы: изучать на практике, как изменяются свойства элементов по мере увеличения заряда их ядра на примере элементов III периода.
О б о р у д о в а н и е и м а т е р и а л ы: коническая колба на 100 см3, фарфоровая чашка, часовое стекло, пробирки, фенолфталеин, метилоранж, сера, натрий, магний, алюминий, растворы: соляной кислоты, едкого натрия.
Методика выполнения работы
Опыт №1. Взаимодействие щелочных металлов с водой.
Налить в фарфоровую чашку немного воды, опустить в неё кусочек натрия и быстро прикрыть чашку часовым стеклом или воронкой. (Осторожно! Брызги щёлочи могут попасть на открытые участки кожи человека и одежды). После окончания реакции прилить к полученному раствору 2-3 капли фенолфталеина. Написать уравнение протекающей реакции.
Опыт №2. Действие воды на металлический магний.
Поместить в пробирку стружку металлического магния, добавить немного воды и 2-3 капли раствора фенолфталеина. Обратить внимание, что цвет раствора практически не изменяется. Затем следует нагреть пробирку. Отметить изменение окраски раствора. Сделать выводы относительно щелочных свойств гидроксида магния и написать уравнение протекающей реакции.
Опыт №3. Амфотерность металлического алюминия.
Поместить кусочек металлического алюминия в пробирку, прилить немного воды и 2-3 капли фенолфталеина. Убедиться в том, что ни в обычных условиях, ни при нагревании алюминий с водой практически не взаимодействуют. Затем поместить в две другие пробирки по кусочку алюминия. В одну из них прилить разбавленную соляную кислоту, в другую -раствор крепкой щёлочи NaOH. Пробирки нагреть. При этом наблюдается взаимодействие алюминия как с кислотами, так и со щелочами. Написать уравнения протекающих реакций и сделать выводы о свойствах алюминия.
Опыт № 4. Неметаллические свойства элементарной серы.
Кусочек элементарной серы поместить в пробирку и налить немного воды. Прибавить сначала 2-3 капли фенолфталеина, а затем - столько же метилоранжа. Отметить, что сера не взаимодействует с водой в обычных условиях. Нагреть пробирку. Обратить внимание, что и после нагревания взаимодействие серы с водой не происходит.
Кусочек серы положить на железную ложечку, поджечь и опустить в коническую колбу, в которую было налито немного воды (ложечкой с горящей серой поверхности воды не касаться). После сгорания серы закрыть колбу пробкой и встряхнуть. Полученный раствор разделить на три пробирки и испытать различными индикаторами. Написать уравнения химических реакций.
