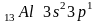- •Задания для практической работы
- •Задания для практической работы
- •Занятие 3. Определение основных характеристик химической связи.
- •Занятие 4. Определение теплового эффекта процессов Пример выполнения упражнения:
- •Задания для практической работы
- •Занятие 5. Химическая кинетика и равновесие Пример решения задачи
- •Задания для практических работ
- •Занятие 6. Ионный обмен, гидролиз солей. Пример выполнения упражнения
- •Задания для практических работ
- •Занятие 7. Комплексные соединения Пример выполнения упражнения.
- •Задания для практических работ
- •Пример выполнения задания
- •Задания для практических работ
- •Пример выполнения упражнения
- •Задания для практической работы
- •ПриложенИе Термодинамические свойства простых веществ и соединений
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
Национальный исследовательский ядерный университет «МИФИ»
Волгодонский инженерно-технический институт – филиал НИЯУ МИФИ
Учебно-методическое пособие
к практическим занятиям по химии
Составитель: к.х.н. В.М.Сапельников
Волгодонск 2015
занятие 1. Закон эквивалентов
Пример решения задачи:
Оксид марганца содержит 22,56% кислорода. Найти эквивалентную массу и валентность марганца в этом соединении. Составить формулу оксида.
Решение. Пусть масса оксида марганца равна 100 г, тогда масса кислорода будет составлять 22,56 г. На основании закона эквивалентов можно составить следующую пропорцию:

Примем Мэ(Мn) = А г/моль, тогда,
согласно правилу суммы
 .
Исходя из определения эквивалентной
массы
.
Исходя из определения эквивалентной
массы
 .
Подставляя полученные значения в
формулу, имеем
.
Подставляя полученные значения в
формулу, имеем
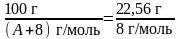 .
.
Решая уравнение относительно А, получим А = 27,5 г/моль.
Валентность марганца (по модулю совпадающую со степенью окисления) определим по формуле, связывающей молярную и эквивалентную массы элемента,
Мэ(Mn) = fэ (Mn )·М(Mn ) = М(Mn ) : В (Mn ),
откуда

Так как в оксидах кислород двухвалентен, получаем следующую формулу оксида марганца: MnO.
Задания для практической работы
1-5. При взаимодействии m, г, n-валентного металла с серной кислотой выделилось V, мл, (н.у.) водорода. Рассчитайте эквивалентную и мольную массы металла, массу прореагировавшей кислоты и массу образовавшейся соли. Какой металл был взят для растворения? Напишите реакцию взаимодействия этого металла с серной кислотой:
Задачи
|
1
|
2
|
3
|
4
|
5
|
m, г
|
0,08
|
0,10
|
0,12
|
0,16
|
0,18
|
n
|
2
|
3
|
3
|
2
|
2
|
V,мл (н.у.)
|
27,4
|
124,5
|
89,6
|
147,5
|
72,2 |
6-10. Оксид n-валентного элемента содержит Х% этого элемента. Вычислите эквивалентные и мольные массы элемента и оксида. Какой элемент образует данный оксид? Напишите уравнение реакции образования этого оксида при взаимодействии элемента с кислородом:
Задачи |
6
|
7
|
8
|
9
|
10
|
n
|
2
|
3 |
7
|
5
|
4
|
X,%
|
87,5
|
69,9
|
69,4
|
43,6
|
46,8
|
11-15. При превращении m1, г, хлорида металла в сульфат было затрачено m2, г, серной кислоты. Определите эквивалентные массы металла, его хлорида и сульфата. Какой это металл, если его валентность равна n?
Задачи
|
11
|
12
|
13
|
14
|
15 |
m1, г |
1,71 |
1,75 |
2,03 |
1,305 |
2,10 |
m2 , г |
1,66 |
1,47 |
1,58 |
0,99
|
1,395 |
n
|
3
|
4
|
2
|
1
|
3
|
Занятие 2. Составление электронных формул атомов и ионов
Пример выполнения упражнения:
Задача.
Какие значения квантовых чисел n,
l,
ml,
ms
имеют
валентные электроны атома
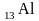 ?
Напишите электронную формулу элемента.
?
Напишите электронную формулу элемента.
Решение. 1. Составим электронную формулу атома алюминия

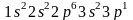 .
.
Известно, что валентными для s и p-элементов являются электроны внешнего слоя. Для атома алюминия это 3s23p1.
2. Состояние электрона в атоме описывается набором четырех квантовых чисел в виде групп символов nlx:
а) n - главное квантовое число, определяется по номеру заполненного уровня;
б) l - побочное (орбитальное) квантовое число. Для s-подуровня l=0; для р-подуровня l=1; для d-подуровня l=2 и т.д.; х - число электронов на этом подуровне;
в) m l
– магнитное квантовое число, принимающее
следующие значения:
 ;
;
г) m s - спиновое квантовое число, принимающее значения 1/2.
13 Al |
3s2 |
|
3p1 |
||||||
|
|
|
|
|
|
|
|
||
n= |
3 3 |
3 1 -1
|
|||||||
l= |
0 0 |
||||||||
ml =
ms= |
0 0
|
||||||||
Для определения квантовых чисел
необходимо распределить валентные
электроны по квантовым ячейкам: