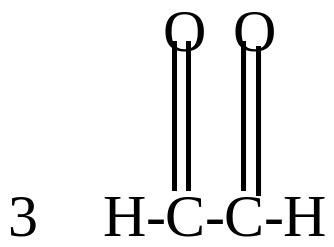- •Химические свойства
- •Правила ориентации в бензольном ядре
- •Электрофильное замещение в бензоле
- •Нитрование гомологов бензола
- •Реакции присоединения (нетипичны)
- •4.6.1.Галоидпроизводные ароматических углеводородов Классификация, изомерия, номенклатура
- •Получение
- •Физические свойства галогенопроизводных ароматических углеводородов
- •Химические свойства
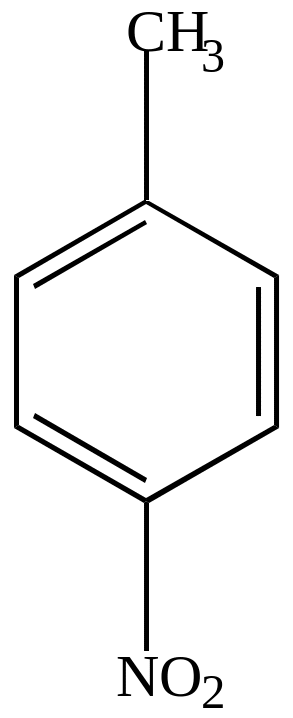
Нитрование гомологов бензола
Можно провести в двух направлениях.
а) Нитрование в ядре, если применить нитрующую смесь.
|
|
|
|
|
|
|
+ HONO2 (H2SO4) |
|
|
|
+ H2O |
|
|
|
|
|
|
Механизм – электрофильный, идет в орто- или пара-положении к группе СН3, как к заместителю 1 рода.
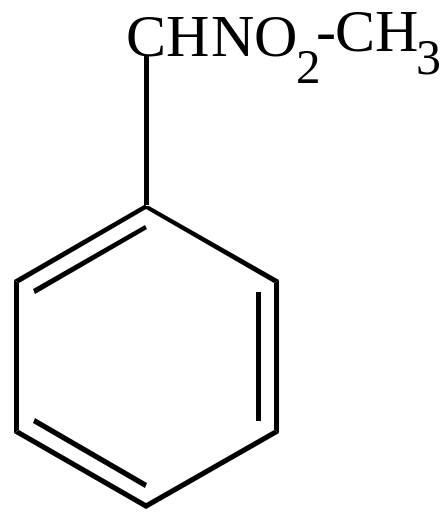
б) нитрование в боковой цепи, если нитровать разбавленной азотной кислотой в условиях реакции Коновалова – механизм свободно-радикальный.
|
+ HONO2 H2O + |
|
|
|
Метилфенилнитрометан |
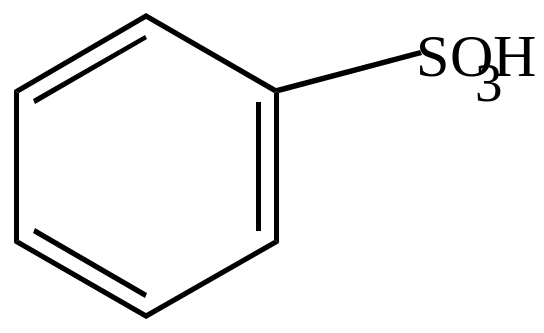
3. Сульфирование.
Сульфирование бензола можно осуществлять действием олеума при комнатной температуре, или концентрированной серной кислотой при температуре 170-1800С.
При снижении концентрации серной кислоты до 65% реакция прекращается.
Реакция обратима, поэтому для достижения хорошего выхода необходимо удалять (связывать) воду, что достигается добавлением избытка серной кислоты, либо избытка углеводорода, который отгоняется вместе с водой.
Механизм – электрофильный.
2 HOSO2OH + HOS+O2OH H3O+ + 2 HOSO2O- + S+O3H
конц. гидросульфониевый
ион
|
+ S+O3H
|
|
+ H+
|
|
|
бензолсульфокислота |
|
H+ + -OSO2OH H2SO4
H3O+ + -OSO2OH H2SO4
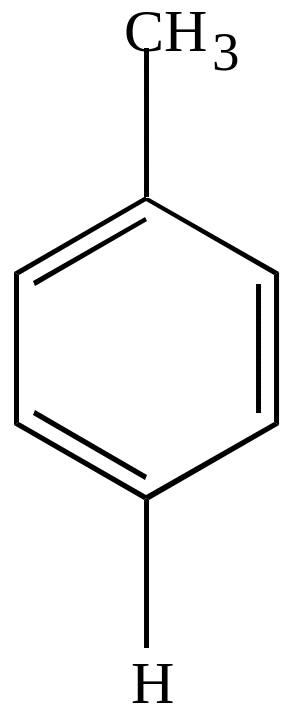
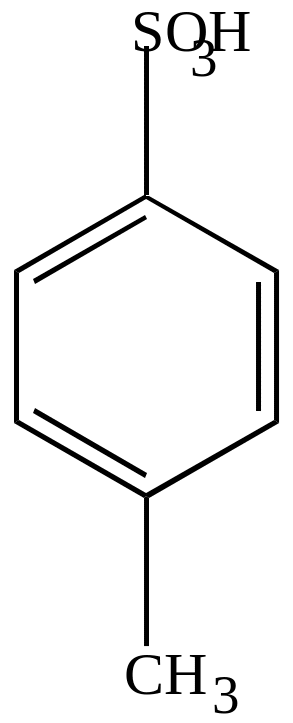
Сульфирование гомологов бензола идет гораздо легче, чем бензола, и, в основном, в пара-положение.
|
+ HOSO2OH -H2O |
|
|
|
П-толуолсульфокислота |
К реакции электрофильного замещения относятся также реакции Фриделя-Крафтса (т.е. алкилирование и ацилирование ароматического ядра в присутствии AlCl3).
Реакции присоединения (нетипичны)
У ароматических углеводородов протекают гораздо труднее, чем у ненасыщенных углеводородов, и только под действием реагентов высокой активности (H2, Cl2). При этом присоединение происходит одновременно у всех шести атомов углерода. Такие реагенты, как Br2, I2, HHal, H2SO4, HOCl, HOH к ароматическому кольцу не присоединяются.
присоединение водорода
Pt, 1000C
+ 3H2
3000C
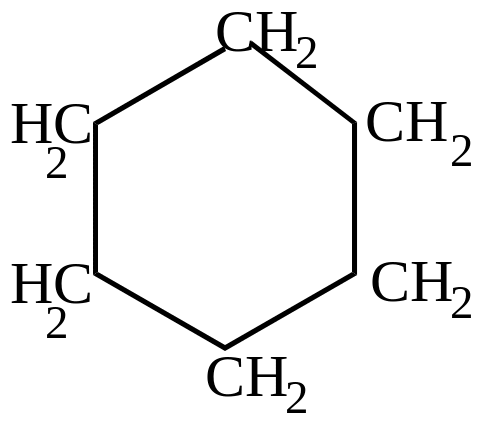
бензол
циклогексан
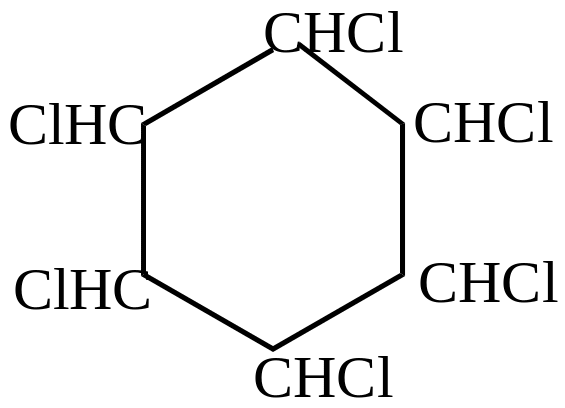
присоединение хлора
|
прямой солнечный свет +3Cl2 |
|
|
|
гексахлоран или гексахлорциклогексан |
Окисление
Бензольное ядро очень устойчиво к окислению. Оно не окисляется KMnO4, K2Cr2O7, азотной кислотой и другими сильными окислителями.
Гомологи бензола достаточно сильно окисляются, но эти реакции идут за счет окисления боковой цепи, бензольное кольцо при этом остается без изменения.
1) Окисление бензола.
Можно осуществить только в следующих случаях:
а) действие кислорода в присутствии катализатора при очень жестких условиях (происходит разрушение кольца).
|
V2O5 +4O2 4500C |
|
+ |
|
O
|
CO2 + H2O |
|
|
м |
|
щавелевая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
|
|
|
|
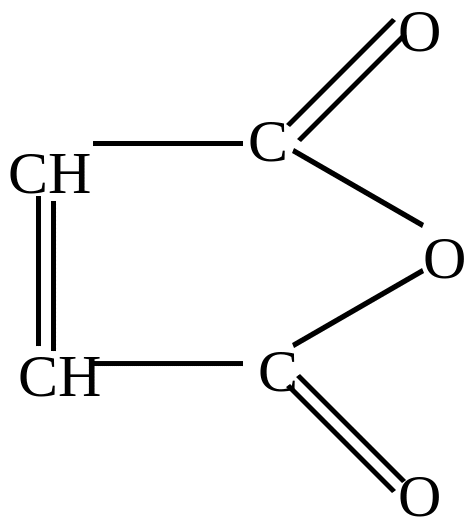
Малеиновый ангидрид |
|
|
|
|
б) озонирование – окисление озоном с разрушением двойных связей кольца.
|
+3O3 |
|
+3H2O
-3H2O2 |
|
|
|
|
|
глиоксаль |
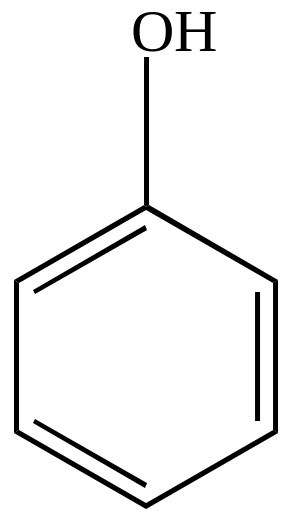
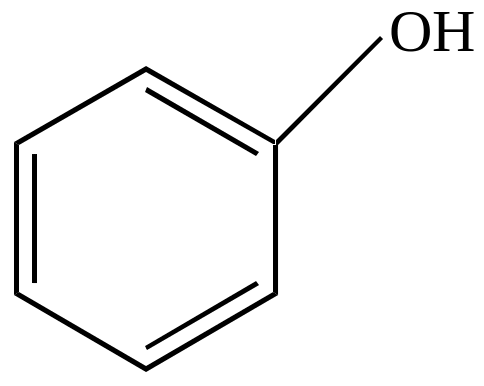
в) окисление перекисями с сохранением бензольного ядра.
|
Fe2+ + HO-OH -H2O |
|
|
|
фенол |
Механизм реакции – свободно-радикальный
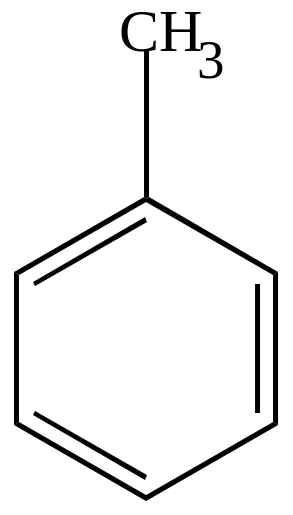
2) Окисление гомологов бензола.
а) под действием сильных окислителей
(KMnO4, HNO3
и др.) или кислорода в присутствии
катализаторов происходит окисление
![]() -углеводородного
звена боковой цепочки с образованием
карбоксильной группы, связанной с ядром.
-углеводородного
звена боковой цепочки с образованием
карбоксильной группы, связанной с ядром.
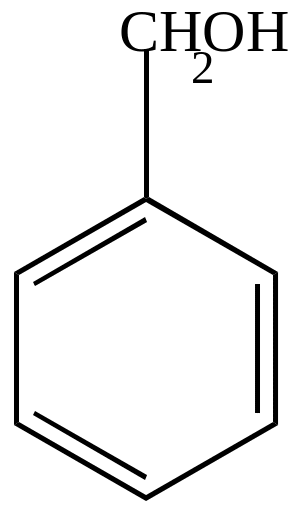
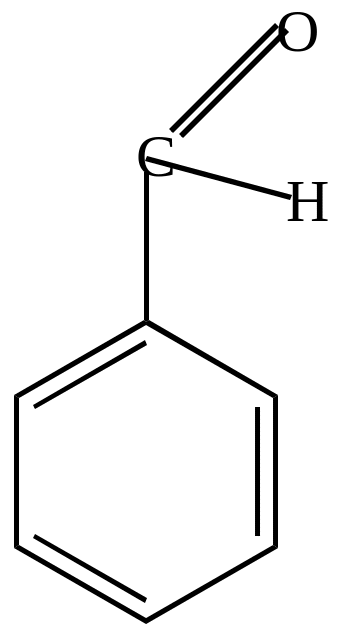
|
+ O (KMnO4) |
|
+O
-H2O |
|
+O
|
|
|
|||||
Толуол |
|
бензиловый спирт |
|
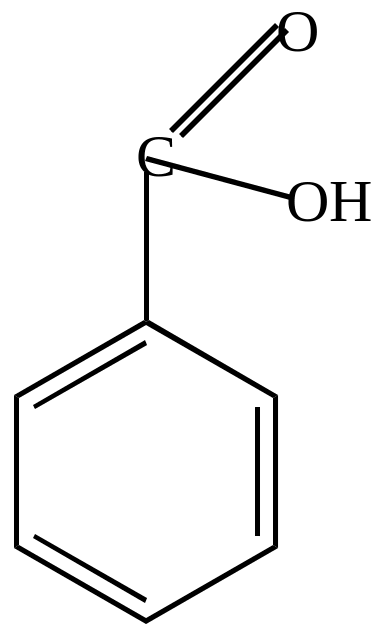
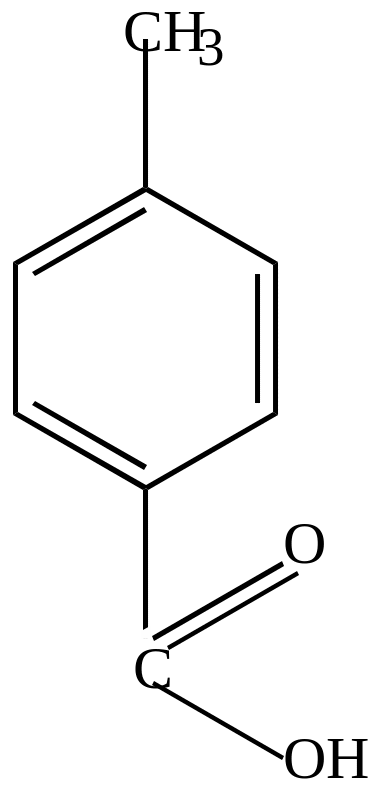
бензальдегид |
|
бензойная кислота |
|
|||||
|
+O |
|
+O -H2O |
|
+3O
- CH3COOH |
|||||||
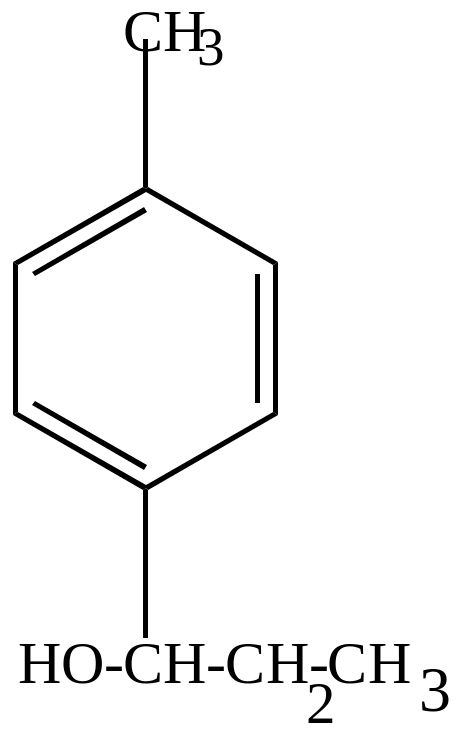
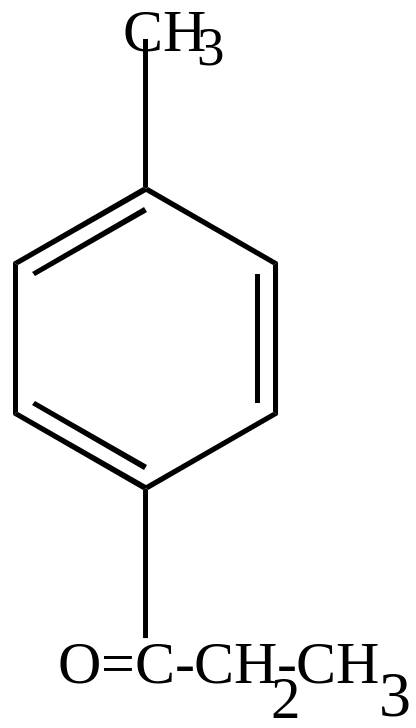
П-метилпропил-бензол |
|
этил-п-толуолкарбинол |
|
этил-п-толуилкетон |
|
|||||||
+3O
- CH3COOH |
|
|
+3O
-H2O |
|
|
|||||||
|
|
п-толуиловая кислота |
|
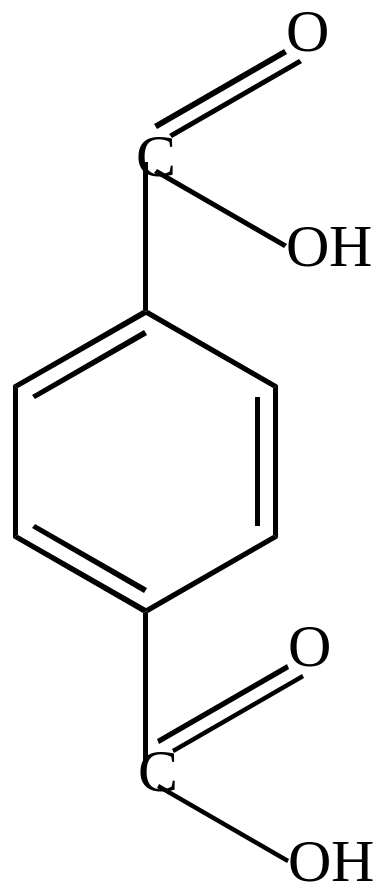
П-бензолдикарбоновая кислота (терефталевая кислота) |
|
|||||||
Промежуточные продукты окисления, как правило, не выделяются в свободном виде – окисление идет до кислот.
Реакция окисления часто используется для установления строения ароматических углеводородов (основность образующейся кислоты всегда соответствует числу боковых цепочек в исходном углеводороде).
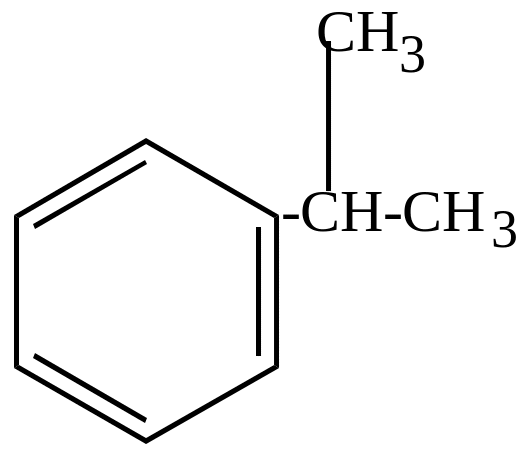
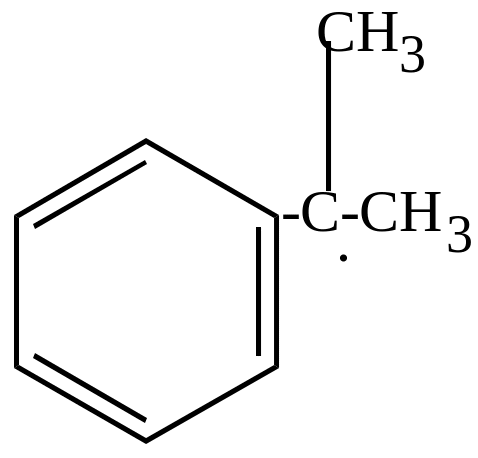
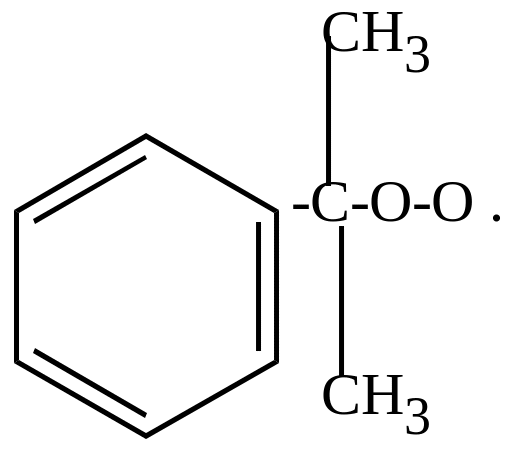
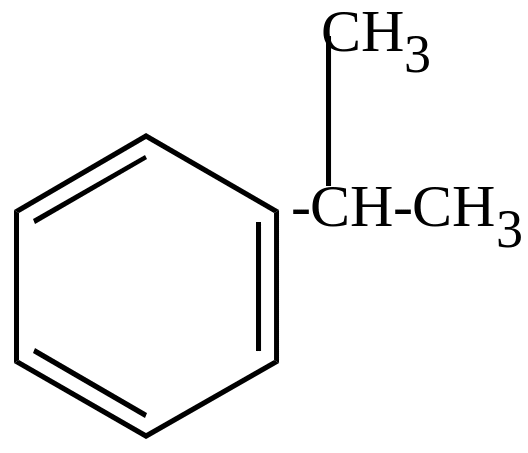
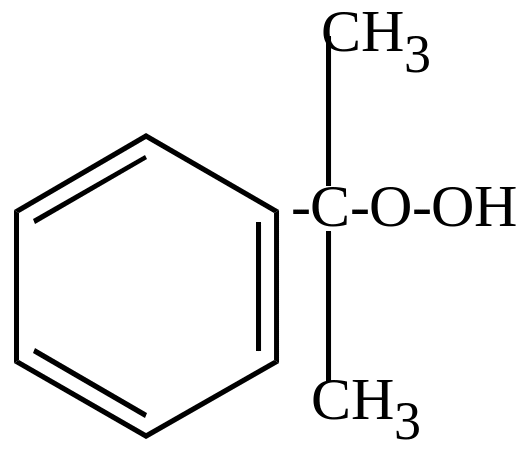
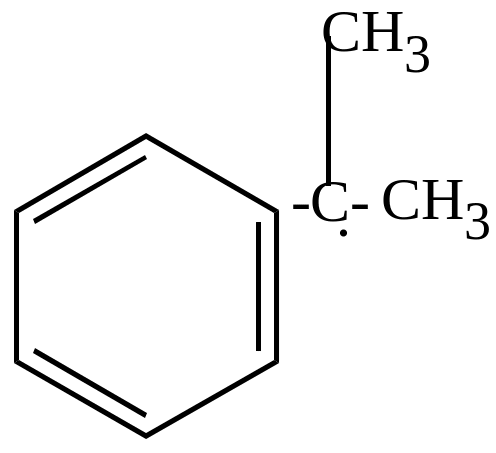
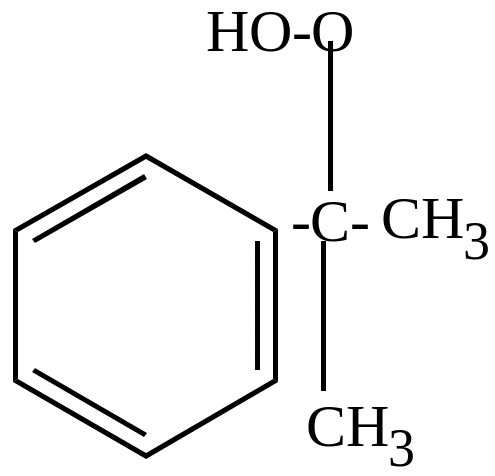
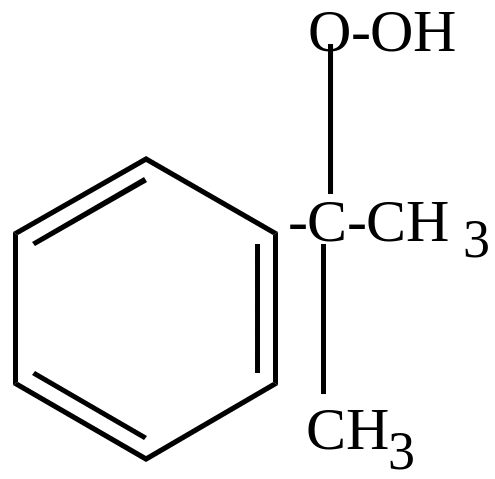
б) окисление молекулярным кислородом в присутствии перекисей идет по цепному механизму и приводит к образованию гидроперекисей, которые затем разлагаются на фенолы, кетоны, альдегиды (в зависимости от строения).
HO-OH HO . + . OH
|
+ . OH H2O + |
|
кумол |
(инициатор) |
|
|
+ O2 |
|
|
+ |
|
|
|
+ |
|
||||
|
|
|
+ |
|
|
|||||
|
|
Фенол |
|
ацетон |
|
|||||
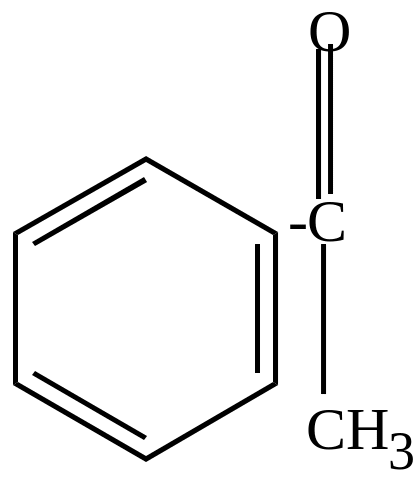
Возможно побочное направление -
![]() -распад
связи С-СН3
-распад
связи С-СН3
|
|
|
+ CH3OH |
|
|
метилфенилкетон |
|



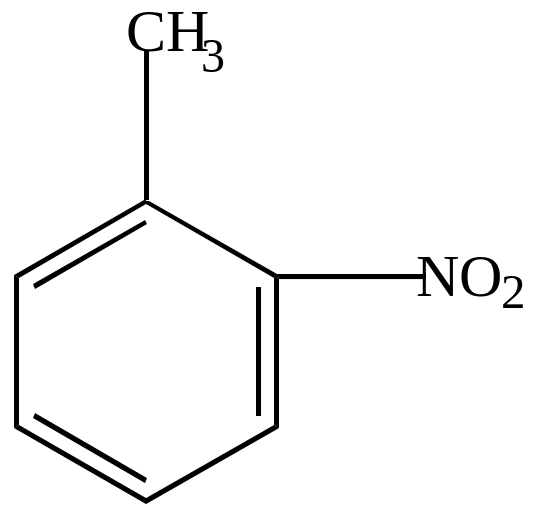
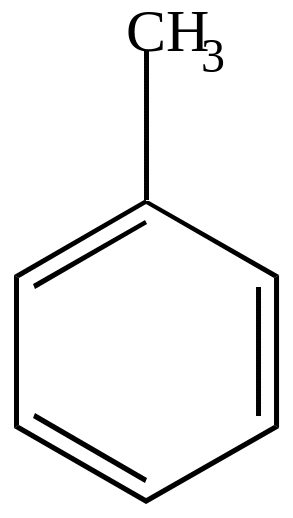

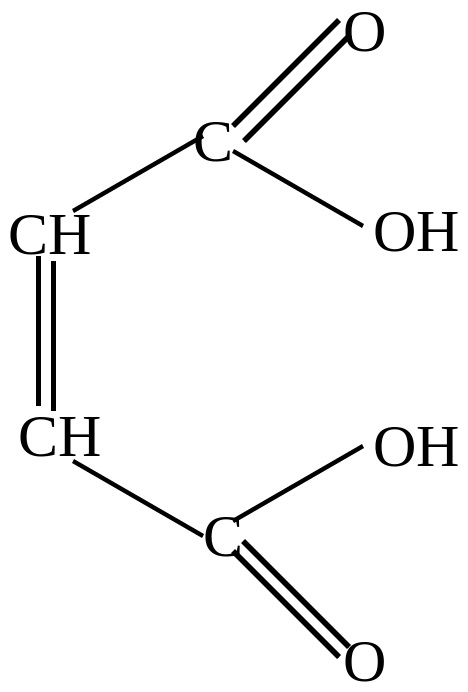
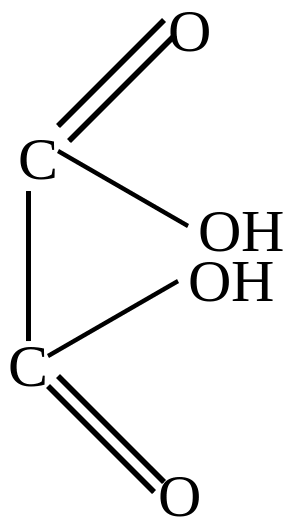
 алеиновая
кислота
алеиновая
кислота