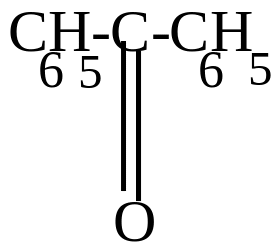- •Способы получения
- •Физические свойства
- •Химические свойства
- •Наиболее важные группы многоядерных соединений. Группа дифенила
- •Группа трифеиилметана
- •Красители типа трифенилметана
- •Полициклические ароматические углеводороды с конденсированными ядрами
- •Получение
- •Физические свойства
- •Особенности химических свойств
|
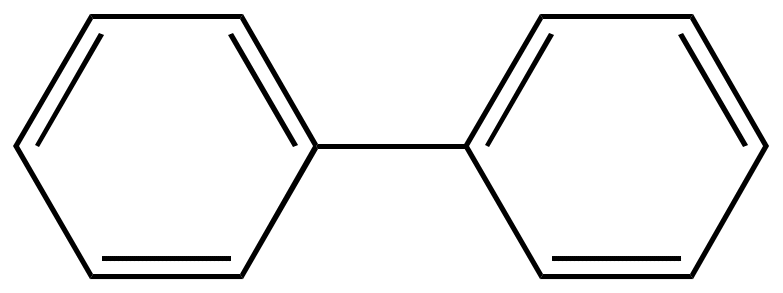
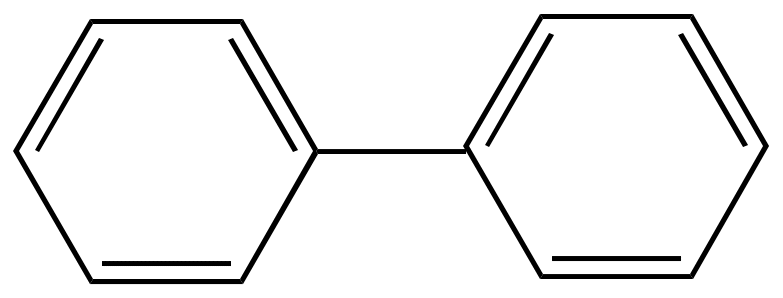
Дифенил |
|
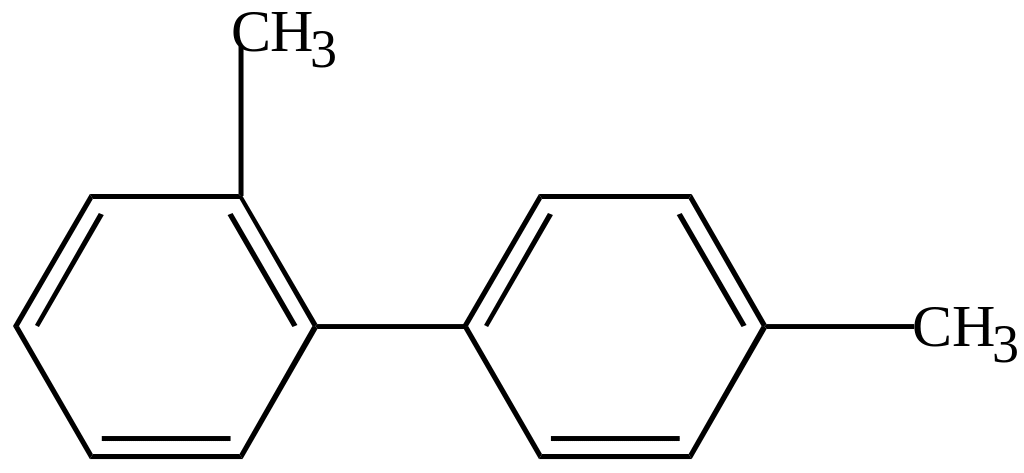
2,4/-диметилдифенил |
|
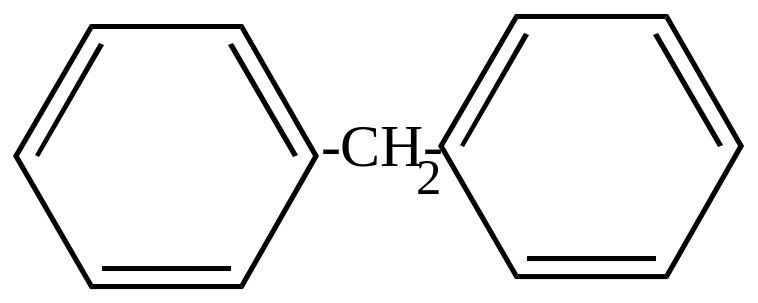
Дифенилметан |
|
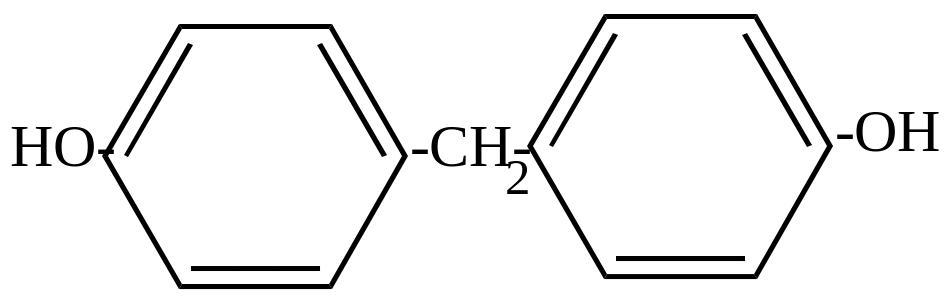
П,п/-диоксидифенилметан; бис(2-оксифенил)метан; 4,4?-метиленбисфенол |
|
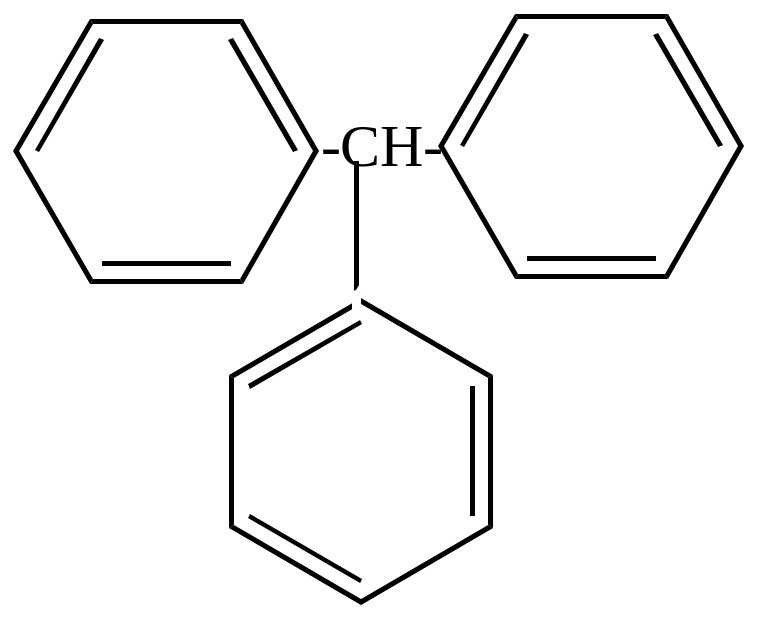
Трифенилметан |
C6H5-CH2-CH2-C6H5 |
Sim-1,2-дифенилэтан |
|
Asim-дифенилэтан |
|
Гексафенилэтан |
Способы получения
Основаны, главным образом, на использовании реакций вюрца-Фиттига и Фриделя-Крафтса. Эти реакции имеют здесь определенное ограничение:
Реакция Вюрца идет только с иодарилами.
2 C6H5I
+ 2 Na
![]() C6H5-C6H5
+ 2 NaI
C6H5-C6H5
+ 2 NaI
2) Для получения многоядерных углеводородов с помощью реакции Фриделя-Крафтса необходимо использовать полигалогенопроизводные углеводородов.
3 |
|
AlCl3 + CHCl3 (C6H5)3CH -3 HCl |
|
хлороформ |
трифенилметан |
Физические свойства
Бесцветные вязкие жидкости или кристаллические термостойкие вещества, нерастворимые в воде.
Химические свойства
Проявляют типичные свойства ароматических углеводородов.
Особенности:
1) Реакции электрофильного замещения в ядре идут труднее, чем у одноядерных (при более жестких условиях). Заместители становятся в основном в положение пар- или орто- (если пара-положение заняты).
Реакции связующего звена.
Атомы водорода,
расположенные в
![]() -положении
к нескольким ядрам, обладают большей
подвижностью и очень легко подвергаются
замещению по различным механизмам.
-положении
к нескольким ядрам, обладают большей
подвижностью и очень легко подвергаются
замещению по различным механизмам.
С6H5-СH2-C6H5 + 2 Cl2 C6H5-CCl2-C6H5 + 2 HCl
дифенилметан дихлордифенилметан
С6H5-СH2-C6H5 + O2 |
|
+ H2O |
|
дифенилкетон (ацетофенон) |
|
Наиболее важные группы многоядерных соединений. Группа дифенила
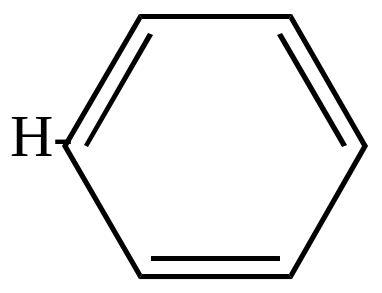
Дифенил может быть получен пиролизом бензола.
|
+ |
|
7000
-H2 |
|
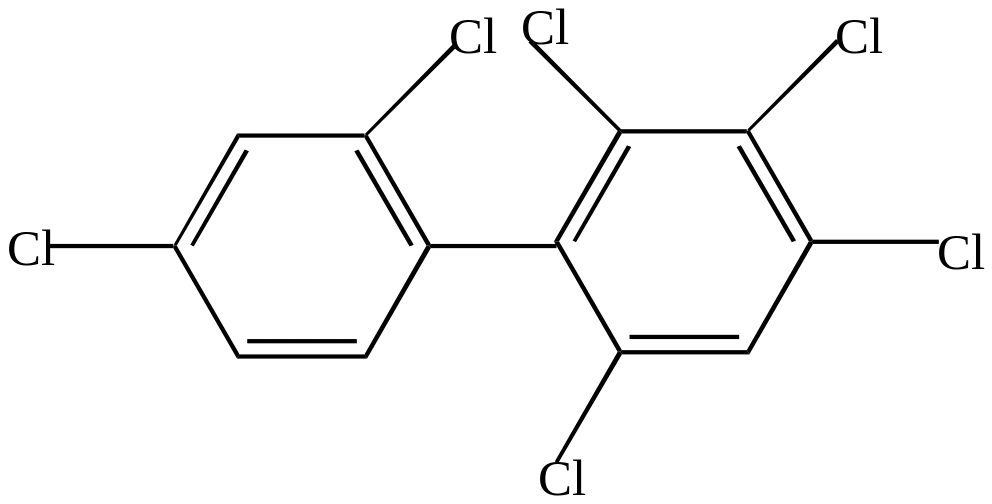
AlCl3 + 3 Cl2 |
|
|
|
|
||
Благодаря такой высокой термостойкости используется в качестве высокотемпературного теплоносителя в реакторах (Тпл=700С, Ткип=2540С). Производные дифенила с заместителями в орто-положениях, могут иметь оптическую изомерию. Известно, что оптическая изомерия наблюдается у соединений, имеющих асимметричный атом углерода. В дифениле два плоских бензольных кольца соединены простой связью и могут свободно вращаться вокруг этой простой связи,
не имея закрепленного положения в пространстве.
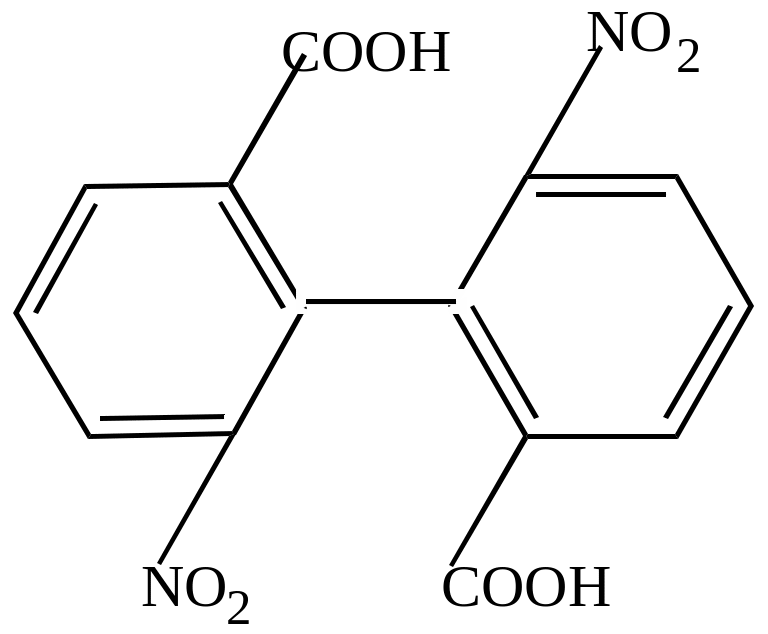
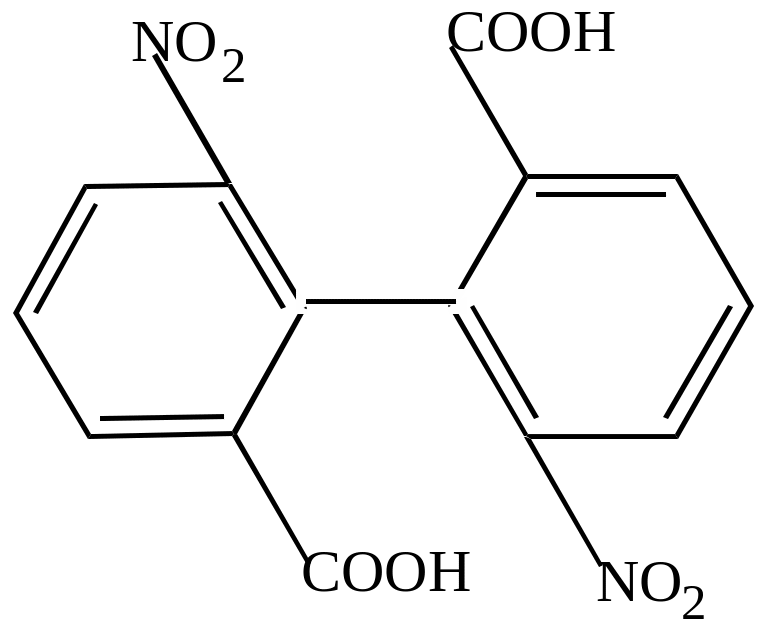
Если в орто-положениях к простой связи имеется несколько заместителей, занимающих значительный объем в пространстве, то они делают свободное вращение невозможным, и кольца приобретают закрепленное положение друг относительно друга. Если сумма радиусов двух о-заместителей превышает 3,0 А0, то расположение ядер в одной плоскости становится невозможным: они поворачиваются друг к другу, под определенным углом, чаще всего под углом 900С. такие молекулы не имеют центра симметрии, и поэтому, хотя у них нет асимметрических атомов, у них наблюдается явление оптической изомерии.
Так, 2,2/-динитродифенил-6,6/-дикарбоновая кислота имеет два изомера:
|
|
Эти две формы отличаются друг от друга как предмет от зеркального изображения – они являются оптическими антиподами.
Такое явление – наличие пространственных оптических изомеров вследствие торможения свободного вращения – получило название поворотной оптической изомерии.