
Консультация Левчишин
.RTFКонсультация к экзамену по физ.химии (ч.I) текст от 11.01.2010
Консультация
Этот файл содержит советы и практические рекомендации для подготовки к экзамену по списку вопросов, представленному на сайте кафедры. Здесь, конечно, рассмотрены далеко не все вопросы. В первую очередь сделаны уточнения для тех вопросов, которые вызывают сомнения в правильном понимании или допускают неоднозначное толкование.
Представленные ниже ответы на некоторые из вопросов не являются полными. Это лишь намек, указание пути, пойдя по которому можно составить правильный ответ. Во всех ссылках на справочник подразумевается «Краткий справочник физико-химических величин» под ред. А.А. Равделя и А.М. Пономаревой. Если упоминается задачник, то речь идет об издании И.В. Кудряшов, Г.С. Каретников «Сборник примеров и задач по физической химии», М.:«Высшая школа», 1991. При составлении ответов на вопросы могут помочь и многие учебники. В некоторых примерах даны ссылки на двухтомный учебник под редакцией проф. К.С.Краснова издания 1995 г. или более позднего (рекомендован-ный министерством в качестве учебника для студентов химико-технологических специальностей). Более полный список учебной литературы по курсу физической химии приведен на сайте кафедры в разделе «Библиография» (ссылка на главной странице).
Законы термодинамики
Первый закон термодинамики, формулировки 1-го закона термодинамики. Внутренняя энергия. Теплота и работа как формы передачи энергии. Взаимосвязь этих величин в изохорном, изобарном и изотермическом процессах
При ответе на этот вопрос надо привести, по меньшей мере, две основные формулировки первого закона (первого начала) термодинамики: первую, постулирующую сохранение энергии при ее передаче в термодинамических процессах, и вторую, подчеркивающую существование внутренней энергии, как экстенсивной функции состояния всех систем. Математические выражения первого закона могут иметь различный вид в разных учебных изданиях, поэтому надо быть очень осторожным при подготовке к экзамену по учебникам. Это относится, например, к понятию «работа». Нельзя сказать, что в выражении первого закона термодинамики упоминается «просто работа». В лекционном курсе физической химии в выражениях первого начала термодинамики обычно используется работа системы над окружением. Если это, к примеру, работа расширения-сжатия газа, то при увеличении объема системы она принимается положительной. В некоторых учебниках (в первую очередь в американских) используют работу внешних сил, противоположную по знаку работе системы, это видоизменяет формулу первого начала термодинамики (см. например Ф.Даниэльс, Р.Олберти. «Физическая химия». Пер. с англ. М.:«Мир», 1978). Поэтому величины, входящие в выражение первого начала, надо называть полностью, например: «работа процесса, то есть работа системы над окружением, положительная работа соответствует убыли энергии системы», «теплота процесса, положительной считается теплота, поглощенная системой» (термодинамическая система знаков для теплоты), «изменение внутренней энергии системы положительно, когда внутренняя энергия системы увеличивается». «Взаимосвязь этих величин в изохорном, изобарном и изотермическом процессах» – требуется записать формулы для теплоты процесса и работы расширения и выражения первого закона применительно к каждому из названных изопроцессов.
_____________
Внутренняя
энергия и энтальпия системы, их
взаимосвязь. Зависимость внутренней
энергии и энтальпии от температуры,
уравнения в дифференциальной форме.
Интегрирование соответствующих
уравнений. Графическая зависимость
 в широком температурном интервале,
включающем точки плавления и кипения
вещества.
в широком температурном интервале,
включающем точки плавления и кипения
вещества.
Существование
внутренней энергии, как экстенсивной
функции состояния всех систем,
постулируется в одной из формулировок
первого начала термодинамики.
Определительное уравнение для энтальпии
(H
= U
+ pV)
содержит внутреннюю энергию и,
следовательно, передает взаимосвязь
этих функций. Уравнения в дифференциальной
форме для зависимостей внутренней
энергии и энтальпии от температуры –
это уравнения для температурных
производных указанных функций, равных,
соответственно изохорной и изобарной
теплоемкостям. Интегрирование этих
уравнений позволяет найти изменения
внутренней энергии и энтальпии
соответственно в изохорном и изобарном
процессах, равные теплоте этих процессов.
«Графическая
зависимость
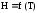 »
– предполагается анализ графика
температурной зависимости приращения
стандартной энтальпии вещества
»
– предполагается анализ графика
температурной зависимости приращения
стандартной энтальпии вещества
 ,
поскольку абсолютное значение энтальпии
вещества неизвестно.
,
поскольку абсолютное значение энтальпии
вещества неизвестно.
_____________
«Изобразите характер изменения энтропии в самопроизвольном процессе, протекающем в изолированной системе». И в другом вопросе: «Изменение энтропии как функция координаты реакции в самопроизвольном процессе».
По-видимому, предполагается построение схематического графика зависимости энтропии от координаты процесса (выпуклая кривая с максимумом), показывающего, что в самопроизвольном процессе в изолированной системе энтропия системы возрастает и в равновесии достигает максимума. Следует обязательно подчеркнуть, что речь идет об энтропии изолированной системы (во втором варианте вопроса это не указано).
_____________
Зависимость энтропии от температуры и давления. Изменение энтропии в изохорических, изобарических и изотермических процессах с участием идеального газа. Изменение энтропии в процессе смешения идеальных газов.
Довольно объемный вопрос. Здесь предполагается анализ выражений (дифференциальных уравнений) для первых частных производных энтропии по температуре (при постоянных давлении или объеме) или по давлению (при постоянной температуре). Изменение энтропии в изопроцессах можно получить путем интегрирования названных дифференциальных уравнений (в простейшем случае – в приближении постоянства теплоемкости идеального газа). Наиболее простой случай смешивания двух идеальных газов – изотермический, когда газы до смешивания имели одну и ту же температуру. В этом случае изменение энтропии при смешивании газов равно сумме изменений энтропии в процессах обратимого изотермического расширения каждого из газов до общего (суммарного) объема. Более сложный случай смешивания газов с различными исходными температурами рассматривался в одной из домашних задач (№ 3, стр. 94 задачника).
_____________
Аналитический и графический методы определения абсолютной энтропии вещества.
Речь
идет о методе определения стандартной
энтропии вещества путем интегрирования
отношения теплоемкости к температуре
(от абсолютного нуля температуры).
Графический вариант метода предполагает
построение графика
 и графическое определение интегралов
(см. домашнюю задачу №23 стр.90 задачника).
Аналитический вариант того же метода
предполагает вычисление интегралов от
той же функции, теплоемкость в которой
задается эмпирическими полиномами или
законом кубов Дебая (вблизи абсолютного
нуля). Существует и другой аналитический
метод расчета энтропии, основанный на
формуле Больцмана-Планка, в которой
термодинамическая вероятность состояния
представляется формулами статистической
термодинамики. Подробности этого
статистического метода расчета на
экзамене не потребуются, так как
соответствующий раздел отсутствует в
учебном плане лекционного курса.
и графическое определение интегралов
(см. домашнюю задачу №23 стр.90 задачника).
Аналитический вариант того же метода
предполагает вычисление интегралов от
той же функции, теплоемкость в которой
задается эмпирическими полиномами или
законом кубов Дебая (вблизи абсолютного
нуля). Существует и другой аналитический
метод расчета энтропии, основанный на
формуле Больцмана-Планка, в которой
термодинамическая вероятность состояния
представляется формулами статистической
термодинамики. Подробности этого
статистического метода расчета на
экзамене не потребуются, так как
соответствующий раздел отсутствует в
учебном плане лекционного курса.
_____________
Идеальные и реальные газы. Фугитивность, коэффициент фугитивности. Химический потенциал реального газа. Приближенный способ расчета фугитивности газа при невысоких давлениях.
Фугитивность
– поправочная функция, которая вводится
вместо давления в уравнение химического
потенциала идеального газа и делает
его применимым для реального газа. Имеет
ту же размерность, что и давление (обычно
атм или бар) Коэффициент фугитивности
–
отношение
фугитивности газа к давлению. Расчет
фугитивности газа делается по формуле,
которую можно вывести, сопоставив
энергию Гиббса идеального и реального
газов (для чистого газа она совпадает
с химическим потенциалом). Для идеального
газа
 .
Для реального газа
.
Для реального газа
 ,
где буквой «f»
обозначена фугитивность. Стандартные
энергии Гиббса идеального и реального
газов совпадают. Разность энергий Гиббса
реального и идеального газов
,
где буквой «f»
обозначена фугитивность. Стандартные
энергии Гиббса идеального и реального
газов совпадают. Разность энергий Гиббса
реального и идеального газов
 .
Производная этой разности по давлению
при T=const
будет иметь вид:
.
Производная этой разности по давлению
при T=const
будет иметь вид:
 (составлено на основе выражения
(составлено на основе выражения
 и уравнения состояния моля идеального
газа
и уравнения состояния моля идеального
газа
 ).
Интегрируя полученное дифференциальное
уравнение по давлению от 0 до P,
получаем:
).
Интегрируя полученное дифференциальное
уравнение по давлению от 0 до P,
получаем:
 (при
(при

 и
и
 ).
Отсюда можно выразить логарифм
коэффициента фугитивности
).
Отсюда можно выразить логарифм
коэффициента фугитивности
 и записать выражение для фугитивности:
и записать выражение для фугитивности:
 .
Таким образом, фугитивность и коэффициент
фугитивности реального газа при
температуре T
и давлении P
могут
быть вычислены по приведенным выше
формулам, если известно уравнение
состояния реального газа, представленное
в виде
.
Таким образом, фугитивность и коэффициент
фугитивности реального газа при
температуре T
и давлении P
могут
быть вычислены по приведенным выше
формулам, если известно уравнение
состояния реального газа, представленное
в виде
 .
Правую часть уравнения состояния надо
подставить вместо объема в подынтегральное
выражение и аккуратно выполнить
интегрирование. Процедура расчета
оказывается в большинстве случаев
довольно сложной, поэтому при невысоких
давлениях для грубой оценки применяют
упрощенный приближенный расчет
фугитивности. Приближенный метод расчета
основан на допущении, что при небольших
давлениях
.
Правую часть уравнения состояния надо
подставить вместо объема в подынтегральное
выражение и аккуратно выполнить
интегрирование. Процедура расчета
оказывается в большинстве случаев
довольно сложной, поэтому при невысоких
давлениях для грубой оценки применяют
упрощенный приближенный расчет
фугитивности. Приближенный метод расчета
основан на допущении, что при небольших
давлениях
 .
Разлагая
экспоненту в ряд Маклорена с сохранением
первых двух членов путем существенных
упрощений в конце концов получают
приближенное выражение для фугитивности
.
Разлагая
экспоненту в ряд Маклорена с сохранением
первых двух членов путем существенных
упрощений в конце концов получают
приближенное выражение для фугитивности
 ,
где P
– давление реального газа, Pидеал
– давление, вычисленное для гипотетического
идеального газа, находящегося в тех же
условиях, что и реальный. Достоинство
этого уравнения в том, что его использование,
казалось бы, не требует полной информации
об изотерме реального газа. Недостаток
упрощенного уравнения в том, что при
его применении изначально не ясно, в
какой мере можно доверять результатам
такого расчета (при отсутствии данных
об изотерме реального газа трудно
оценить справедливость сделанных
допущений).
,
где P
– давление реального газа, Pидеал
– давление, вычисленное для гипотетического
идеального газа, находящегося в тех же
условиях, что и реальный. Достоинство
этого уравнения в том, что его использование,
казалось бы, не требует полной информации
об изотерме реального газа. Недостаток
упрощенного уравнения в том, что при
его применении изначально не ясно, в
какой мере можно доверять результатам
такого расчета (при отсутствии данных
об изотерме реального газа трудно
оценить справедливость сделанных
допущений).
Химическое равновесие
Закон действующих масс и его термодинамическое обоснование. Термодинамическая и эмпирическая константы химического равновесия.
Наиболее общим выражением термодинамического закона действующих масс является представление термодинамической константы равновесия в виде отношения произведений равновесных активностей продуктов и реагентов в степенях их стехиометрических коэффициентов в уравнении реакции:

где
с индексом i
записаны активности и стехиометрические
коэффициенты продуктов реакции, а с
индексом j
– те же данные для исходных веществ,
все стехиометрические коэффициенты
положительны. Термодинамическим
обоснованием этого выражения является
его вывод из уравнения изотермы химической
реакции, записанного применительно к
условиям равновесия (когда
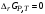 ).
Термодинамическая константа равновесия
реакции с конкретным набором
стехиометрических коэффициентов и
известным фазовым состоянием веществ
при каждой температуре имеет единственное
значение (зависит только от температуры).
Как вспомогательные величины по
экспериментальным данным могут быть
вычислены эмпирические константы
равновесия, выраженные через равновесные
парциальные давления, концентрации или
даже числа моль реагентов и продуктов.
Для реакций в идеальной газовой смеси
эти константы связаны простыми уравнениями
с термодинамической константой равновесия
и в определенных частных случаях могут
численно совпадать с ней. Для реакций
в неидеальной (реальной) газовой смеси
термодинамическая константа равновесия
может быть выражена через равновесные
парциальные фугитивности реагентов и
продуктов.
).
Термодинамическая константа равновесия
реакции с конкретным набором
стехиометрических коэффициентов и
известным фазовым состоянием веществ
при каждой температуре имеет единственное
значение (зависит только от температуры).
Как вспомогательные величины по
экспериментальным данным могут быть
вычислены эмпирические константы
равновесия, выраженные через равновесные
парциальные давления, концентрации или
даже числа моль реагентов и продуктов.
Для реакций в идеальной газовой смеси
эти константы связаны простыми уравнениями
с термодинамической константой равновесия
и в определенных частных случаях могут
численно совпадать с ней. Для реакций
в неидеальной (реальной) газовой смеси
термодинамическая константа равновесия
может быть выражена через равновесные
парциальные фугитивности реагентов и
продуктов.
_____________
Влияние температуры, давления и инертного газа на равновесный выход продукта реакции. Разобрать на примере газофазной реакции (дано уравнение).
Влияние
температуры на равновесный выход
продукта проанализировать проще всего.
Для этого надо записать уравнение
изобары Вант-Гоффа, показывающее, как
изменяется термодинамическая константа
равновесия с ростом температуры. В
первом приближении можно допустить
постоянство стандартного изменения
энтальпии
 реакции (это приближение тем точнее,
чем больше
реакции (это приближение тем точнее,
чем больше
 и меньше
и меньше
 )
и вычислить
)
и вычислить
 ,
используя первое следствие из закона
Гесса. Знак
,
используя первое следствие из закона
Гесса. Знак
 указывает и знак температурной производной
логарифма константы равновесия, то есть
указывает на увеличение или уменьшение
указывает и знак температурной производной
логарифма константы равновесия, то есть
указывает на увеличение или уменьшение
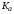 с ростом температуры. Увеличение
константы равновесия означает смещение
равновесия вправо и возрастание
равновесного выхода продуктов, уменьшение
с ростом температуры. Увеличение
константы равновесия означает смещение
равновесия вправо и возрастание
равновесного выхода продуктов, уменьшение
 указывает на противоположный эффект.
Влияние давления и инертного газа на
равновесие реакции в идеальной газовой
смеси можно проанализировать, записав
уравнения связи
указывает на противоположный эффект.
Влияние давления и инертного газа на
равновесие реакции в идеальной газовой
смеси можно проанализировать, записав
уравнения связи
 c
эмпирическими константами равновесия
c
эмпирическими константами равновесия
 ,
,
 и
и
 .
Анализ этих уравнений основан на том,
что при каждой температуре
.
Анализ этих уравнений основан на том,
что при каждой температуре
 ,
изменение одного из сомножителей
вызывает соответствующее изменение
другого (подробности см. в лекционном
курсе).
,
изменение одного из сомножителей
вызывает соответствующее изменение
другого (подробности см. в лекционном
курсе).
_____________
Влияние соотношения реагентов на смещение химического равновесия на примере газофазной реакции (дано уравнение).
В данном случае речь идет об изменении соотношения исходных реагентов по сравнению со стехиометрическим, определяемым по уравнению реакции. При стехиометрическом соотношении реагентов их степени превращения оказываются одинаковыми. Если изменить соотношение исходных реагентов, то появится не реагирующий избыток одного или нескольких из них. Это увеличивает степень превращения реагента, находящегося в недостатке.
Рассмотрим
влияние изменения соотношения реагентов
на положение равновесия реакции 2NO(г)
+ O2(г)
= 2NO2(г).
Обозначим соотношение чисел моль NO
и кислорода в момент начала реакции
буквой z,
начальное количество кислорода n0
моль, начальное количество NO
будет zn0
моль. Обозначим буквой y
число моль кислорода, прореагировавшего
к моменту достижения равновесия, тогда
числа моль прореагировавшего NO
и образовавшегося NO2
в соответствии с уравнением реакции
составят 2у
моль. В условиях равновесия останется
(zn0
– 2у)
моль непрореагировавшего NO
и (n0
– у)
моль кислорода. Запишем выражение
термодинамической константы равновесия
 ,
численно равной константе равновесия
,
численно равной константе равновесия
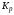 ,
равновесные парциальные давления
реагентов в которой выражены в атмосферах:
,
равновесные парциальные давления
реагентов в которой выражены в атмосферах:

Составим
выражения для равновесных мольных долей
и равновесных парциальных давлений
компонентов газовой смеси. Общее число
моль компонентов в условиях равновесия
 моль.
моль.
Равновесные
мольные доли компонентов
 .
Равновесные парциальные давления
компонентов при общем давлении смеси
P
выражаются по закону Дальтона:
.
Равновесные парциальные давления
компонентов при общем давлении смеси
P
выражаются по закону Дальтона:
 .
Подставим равновесные парциальные
давления в выражение константы равновесия:
.
Подставим равновесные парциальные
давления в выражение константы равновесия:
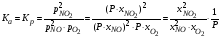
В полученное выражение подставим равновесные мольные доли компонентов:

Выражение,
составленное подобно константе равновесия
из равновесных чисел моль компонентов
смеси
 назовем эмпирической константой
равновесия
назовем эмпирической константой
равновесия
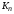 .
Подставив в выражение
.
Подставив в выражение
 общее равновесное число моль компонентов
смеси, запишем окончательное выражение
и проанализируем его:
общее равновесное число моль компонентов
смеси, запишем окончательное выражение
и проанализируем его:

Стехиометрической
смеси реагентов соответствует значение
z
= 2. Изменение соотношения реагентов
накладывает ограничения на возможные
значения y.
Из условия неотрицательности чисел
моль реагентов и продукта можем записать
систему неравенств:
 ,
,
 и
и
 .
Преобразуя эти неравенства, можно
составить условия, ограничивающие
возможные значения y:
.
Преобразуя эти неравенства, можно
составить условия, ограничивающие
возможные значения y:
 (актуально
при
(актуально
при
 ,
т.е. при избытке NO);
,
т.е. при избытке NO);
 (актуально
при
(актуально
при
 ,
т.е. при избытке O2).
,
т.е. при избытке O2).
Трудность
анализа полученного выражения заключается
в том, что при изменении z
меняется и значение y.
Увеличение z
в сторону значительного избытка NO
при постоянстве температуры и общего
давления смеси P
приведет к росту числителя во втором
сомножителе. Это вызовет уменьшение
 и кажущееся смещение равновесия влево.
Количественный анализ записанных
выражений показывает, что с ростом z
монотонно
увеличивается и значение y.
К примеру, при температуре 800К константа
равновесия
и кажущееся смещение равновесия влево.
Количественный анализ записанных
выражений показывает, что с ростом z
монотонно
увеличивается и значение y.
К примеру, при температуре 800К константа
равновесия
 данной реакции равна 0,50. При общем
давлении 1 атм и начальном значении
данной реакции равна 0,50. При общем
давлении 1 атм и начальном значении
 моль
расчетные значения у
составляют 1,0 при z
= 4 (степень превращения кислорода 50%);
1,5 при z
= 12 (степень превращения кислорода 75%).
В стехиометрической смеси (при z
= 2) степень превращения реагентов будет
составлять 33,3% (1/3). Увеличение z
действительно приводит к уменьшению
моль
расчетные значения у
составляют 1,0 при z
= 4 (степень превращения кислорода 50%);
1,5 при z
= 12 (степень превращения кислорода 75%).
В стехиометрической смеси (при z
= 2) степень превращения реагентов будет
составлять 33,3% (1/3). Увеличение z
действительно приводит к уменьшению
 ,
но это в данном случае не означает
смещения равновесия влево, поскольку
число z
входит и в знаменатель выражения
,
но это в данном случае не означает
смещения равновесия влево, поскольку
число z
входит и в знаменатель выражения
 .
Таким образом, увеличение соотношения
реагентов по сравнению со стехиометрическим
позволяет добиться роста степени
превращения реагента, остающегося в
недостатке.
.
Таким образом, увеличение соотношения
реагентов по сравнению со стехиометрическим
позволяет добиться роста степени
превращения реагента, остающегося в
недостатке.
_____________
Запишите уравнение изотермы Вант-Гоффа для химической реакции Mg(тв) + 2H2O(г) = Mg(OH)2(тв) + H2(г), в которой участвуют идеальные газы и практически чистые вещества в твёрдом состоянии, а газообразные вещества – идеальные газы. Приведите варианты уравнения для случаев начала реакции и ее завершения (т.е. установления состояния равновесия). Запишите выражение термодинамической константы равновесия данной реакции.
Приведенная
реакция является гетерогенной, в
равновесной смеси присутствуют две
твердые фазы (магний и гидроксид магния
– смесь кристаллов) и газовая смесь,
состоящая из воды и водорода. Если
принять твердые фазы образованными
практически чистыми веществами, то
активности магния и гидроксида магния
можно считать равными единице. При
невысоких давлениях и достаточно высоких
температурах газовую смесь можно считать
идеальной, тогда активности водорода
и воды будут численно равны их парциальным
давлениям, выраженным в атмосферах.
Таким образом, в выражении под логарифмом
в уравнении изотермы остаются только
парциальные давления газообразных
компонентов системы. Вариант уравнения
изотермы для случая начала реакции
соответствует общему виду данного
уравнения с уточнением, что началу
самопроизвольной реакции при P=const,
T=const
соответствует условие
 .
Вариант уравнения изотермы для равновесия
получается в случае, когда
.
Вариант уравнения изотермы для равновесия
получается в случае, когда
 и под логарифмом стоят равновесные
активности реагентов и продуктов.
Преобразование уравнения изотермы
приводит к уравнению связи стандартного
изменения энергии Гиббса в реакции с
логарифмом термодинамической константы
равновесия:
и под логарифмом стоят равновесные
активности реагентов и продуктов.
Преобразование уравнения изотермы
приводит к уравнению связи стандартного
изменения энергии Гиббса в реакции с
логарифмом термодинамической константы
равновесия:
 .
Равновесные активности магния и
гидроксида магния также равны единице,
поэтому в выражение константы равновесия
данной реакции входят только равновесные
парциальные давления водорода и воды.
Если газовая смесь не является идеальной,
то вместо парциальных давлений
используются равновесные парциальные
фугитивности (летучести).
.
Равновесные активности магния и
гидроксида магния также равны единице,
поэтому в выражение константы равновесия
данной реакции входят только равновесные
парциальные давления водорода и воды.
Если газовая смесь не является идеальной,
то вместо парциальных давлений
используются равновесные парциальные
фугитивности (летучести).
_____________
Расчет стандартного химического сродства и константы химического равновесия при различных температурах.
Этот
компактный вопрос предполагает
пространный ответ. Начать его надо с
того, что стандартное химическое сродство
 и термодинамическая константа равновесия
связаны между собой простым выражением
и термодинамическая константа равновесия
связаны между собой простым выражением
 (следствие уравнения изотермы химической
реакции, записанного для условий
равновесия, когда
(следствие уравнения изотермы химической
реакции, записанного для условий
равновесия, когда
 ).
Если в вопросе имеется в виду теоретический
расчет по справочным данным о
термодинамических свойствах веществ,
то следует рассмотреть все соответствующие
методы расчета, с указанием их возможностей
и ограничений. Если же в вопросе имеется
в виду расчет по экспериментальным
данным, то надо показать, как по этим
данным можно вычислить эмпирическую
константу равновесия, а затем и
термодинамическую константу равновесия.
).
Если в вопросе имеется в виду теоретический
расчет по справочным данным о
термодинамических свойствах веществ,
то следует рассмотреть все соответствующие
методы расчета, с указанием их возможностей
и ограничений. Если же в вопросе имеется
в виду расчет по экспериментальным
данным, то надо показать, как по этим
данным можно вычислить эмпирическую
константу равновесия, а затем и
термодинамическую константу равновесия.
_____________
Определение теплового эффекта реакции по зависимости константы химического равновесия от температуры. Аналитические и графические методы.
В
соответствии с уравнением изобары
Вант-Гоффа
 запишем
запишем

можно
предложить три варианта аналитического
расчета по зависимостям
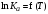 или
или
 или
или
 .
Если для любого из этих вариантов
известно аналитическое представление
зависимости, то несложно взять
соответствующую производную и вычислить
тепловой эффект. Если же зависимость в
одном из трех вариантов представлена
графически (хорошо бы показать все
варианты графиков для эндотермической
или экзотермической реакции), то для
определения производной надо строить
касательную и определять тангенс угла
наклона. Предпочтительнее работать в
координатах
.
Если для любого из этих вариантов
известно аналитическое представление
зависимости, то несложно взять
соответствующую производную и вычислить
тепловой эффект. Если же зависимость в
одном из трех вариантов представлена
графически (хорошо бы показать все
варианты графиков для эндотермической
или экзотермической реакции), то для
определения производной надо строить
касательную и определять тангенс угла
наклона. Предпочтительнее работать в
координатах
 ,
так как в этих координатах температурная
зависимость константы равновесия обычно
существенно спрямляется.
,
так как в этих координатах температурная
зависимость константы равновесия обычно
существенно спрямляется.
_____________
Используя метод комбинирования уравнений химических реакций, выразите термодинамическую константу равновесия реакции (дано уравнение) через константы равновесия Ka,1 – Ka,4 ниже приведенных реакций (дан список из четырех уравнений).
Названный
метод основан на утверждении о том, что
энергия Гиббса есть функция состояния.
Задача заключается в том, чтобы получить
уравнение заданной реакции, складывая
друг с другом или вычитая уравнения
других перечисленных реакций, возможно
предварительно умноженные на константу.
Когда требуемые действия с уравнениями
найдены, те же операции надо проделать
с соответствующими стандартными
изменениями энергии Гиббса реакций. А
затем вспомнить о том, что
 и представить в соответствии с этим
уравнением каждое из записанных
слагаемых. После этого сократить –RT
в левой и правой частях получившегося
уравнения и выполнить потенцирование.
и представить в соответствии с этим
уравнением каждое из записанных
слагаемых. После этого сократить –RT
в левой и правой частях получившегося
уравнения и выполнить потенцирование.
Фазовое равновесие в однокомпонентных системах
Фазовые равновесия в однокомпонентных системах. Диаграмма состояния. Вывод и анализ уравнения Клапейрона-Клаузиуса для процессов плавления-кристаллизации или (в других вариантах вопроса) испарения (парообразования)-конденсации, возгонки (сублимации)-десублимации (конденсации).
Дифференциальное уравнение, описывающее наклон любой линии моновариантного равновесия на p-T-диаграмме состояния однокомпонентной системы, имеет вид:
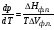
и называется уравнением Клапейрона-Клаузиуса (в некоторых изданиях – уравнением Клапейрона, что исторически более точно, поскольку подобное уравнение было получено Б.П.Э. Клапейроном в 1834г. при рассмотрении конденсации пара, в 1850 году Клаузиус обобщил его на другие фазовые переходы первого рода). Именно это уравнение требуется анализировать в вопросах 75, 76, 84. Применительно к процессам парообразования или возгонки при невысоких давлениях, когда одна из фаз – идеальный газ с мольным объемом, значительно большим, чем у жидкости или твердой фазы, данное уравнение преобразуют к виду

Это уравнение Клапейрона-Клаузиуса для равновесий с участием идеальной газовой фазы (соответствующие преобразования были сделаны Клаузиусом в 1850 году). Если в конкретном варианте вопроса упоминается равновесие с участием пара, т.е. процессы «испарения (парообразования)-конденсации» или «возгонки (сублимации)-десублимации (конденсации)», то для полного ответа придется вывести и проанализировать оба уравнения.
_____________
Изобразите
схематически график
 для процесса испарения в случае, когда
для процесса испарения в случае, когда
 .
Приведите выражение для расчета средней
теплоты испарения. Как рассчитать
величину
.
Приведите выражение для расчета средней
теплоты испарения. Как рассчитать
величину
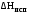 при некоторой температуре
при некоторой температуре
 ,
если указанная зависимость имеет
нелинейный характер. Дайте необходимые
пояснения.
,
если указанная зависимость имеет
нелинейный характер. Дайте необходимые
пояснения.
Оговорка
 буквально
означает «теплота испарения не есть
функция температуры», хотя авторы
вопроса, по-видимому, отождествляют это
с высказыванием «теплота испарения не
зависит от температуры», при проверке
ответа на вопрос ожидается понимание
этого как «теплота испарения постоянна»,
т.е.
буквально
означает «теплота испарения не есть
функция температуры», хотя авторы
вопроса, по-видимому, отождествляют это
с высказыванием «теплота испарения не
зависит от температуры», при проверке
ответа на вопрос ожидается понимание
этого как «теплота испарения постоянна»,
т.е.
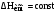 – допущение, соответствующее термину
«средняя теплота испарения в интервале
температур». При расчете средней теплоты
испарения в интервале температур
неопределенно интегрируют уравнение
Клапейрона-Клаузиуса с использованием
упомянутого выше допущения и получают
уравнение прямой в координатах lnP
= f(1/T),
имеющее вид
– допущение, соответствующее термину
«средняя теплота испарения в интервале
температур». При расчете средней теплоты
испарения в интервале температур
неопределенно интегрируют уравнение
Клапейрона-Клаузиуса с использованием
упомянутого выше допущения и получают
уравнение прямой в координатах lnP
= f(1/T),
имеющее вид
