
- •Загальна характеристика методів аналізу
- •2. Гравіметричний (ваговий) метод аналізу
- •3. Титриметричні методи аналізу
- •3.1. Види концентрації, що використовують у титриметричному аналізі
- •3.2. Розрахунки в титриметричному аналізі
- •Приклади розрахунків
- •3.3. Способи приготування титрованих розчинів
- •3.4. Метод кислотно-основного титрування (метод нейтралізації)
- •3.5. Метод окисно-відновного титрування
- •Напрямок і послідовність, швидкість окисно-відновних реакцій
- •Способи фіксації точки еквівалентності
- •3.6 Методи осадження та комплексоутворення
- •3.6.1 Загальна характеристика. Класифікація
- •Способи фіксації точки еквівалентності
- •4. Вимоги до виконання розрахункової роботи (рр)
- •Студент при виконанні розрахункової роботи відповідає на питання і вирішує задачі із завдання варіанта, який визначено йому викладачем (таблиця варіантів контрольних завдань).
- •Правила оформлення індивідуальної рр
- •Варіанти контрольних завдань розрахункової роботи
- •Питання до розрахункової роботи № 1 на тему: «Гравіметрія. Титриметричні методи аналізу. Кислотно-основне титрування»
- •Питання розрахункової роботи № 2 на тему:«Методи окислення-відновлення, осадження і комплексоутворення»
- •Список літератури
- •Розрахункова робота № 1
- •Розрахункова робота № 2
3. Титриметричні методи аналізу
Титриметричний аналіз ґрунтується на вимірюванні об'єму реактиву, витраченого на реакцію з речовиною, яку визначають. Реактив найзручніше застосовувати у вигляді розчину відомої концентрації, а потім виміряти об'єм розчину, витраченого на взаємодію з компонентом, який визначають. Процес додавання одного розчину, який міститься в бюретці, до другого розчину називається титруванням.
В титриметричному аналізі розчин з точно відомою концентрацією називають титрованим або робочим розчином; іноді застосовують термін стандартний розчин. При титруванні до визначуваного розчину поступово добавляють робочий розчин доти, поки кількість молей еквівалентів його в усьому об'ємі розчину рівнялась би кількості молей еквівалентiв речовини, яку визначають. Цей момент титрування називають точкою еквівалентності.
3.1. Види концентрації, що використовують у титриметричному аналізі
Молярна концентрація
Молярна концентрація виражається числом молей речовини в 1 л розчину. Використовують таку форму позначення молярної концентрації:
C(HCl) = 0,1моль/л; 0,1M HCl.
Нормальна концентрація (молярна концентрація еквівалента)
Визначається числом молей еквівалентів речовини в 1 л розчину. Використовують таку форму позначення нормальної концентрації:
C(1/2 H2SO4) = 1 моль/л; 1 н. H2SO4.
Масові концентрації
Титр розчину це маса речовини А в грамах (або в міліграмах), що міститься в 1 мл розчину. Наприклад:
T(A) = 0,004357 г/мл.
Титр розчину по речовині, яку визначають це маса речовини В у грамах або в міліграмах, що реагує з 1 мл розчину реактиву А. Наприклад:
T(HCl/NaOH) = 0,004258 г/мл.
Цей запис читають так: титр соляної кислоти за гідроксидом натрію. Він означає, що 0,004258 г NaOH титрується 1 мл розчину HCl, тобто число молей NaOH, що міститься в 0,004258 г NaOH, дорівнює числу молей HCl у 1 мл розчину HCl.
Знаючи нормальну концентрацію розчину, легко обчислити його титр:
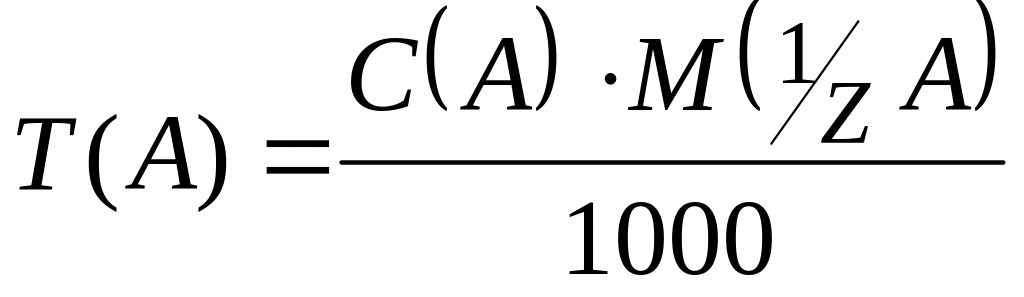 .
.
Формула переходу від простого титру до титру по речовині, яку визначають, має вигляд:
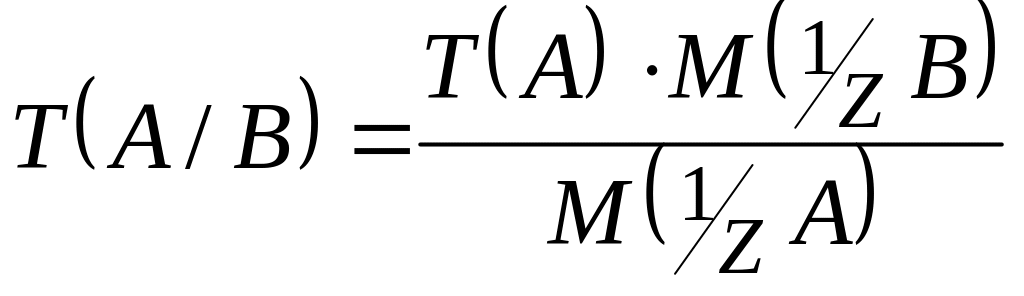 ,
,
де
М(![]() А),
М(
В)
– молярні маси еквівалентів речовин А
i В.
А),
М(
В)
– молярні маси еквівалентів речовин А
i В.
3.2. Розрахунки в титриметричному аналізі
Всі розрахунки в титриметричному аналізі базуються на понятті точки еквівалентності. Точка еквівалентності момент титрування, в якому число молей еквівалентів робочого розчину дорівнює числу молей еквівалентів речовини, яку визначають. Необхідно відрізняти поняття точки еквівалентності від точки кінця титрування. Точка кінця титрування це момент титрування, при якому індикатор різко змінює своє забарвлення.
Приклади розрахунків
1. Розчин речовини А об'ємом V(A) титрують розчином речовини В з відомою нормальною концентрацією С( B). На титрування пішло V(B) мл розчину B. Знайти нормальну концентрацію розчину А.
Рішення. В точці еквівалентності число молей еквівалентів речовини A (n(A)) дорівнює числу молей еквівалентів речовини В (n(B)). Так як
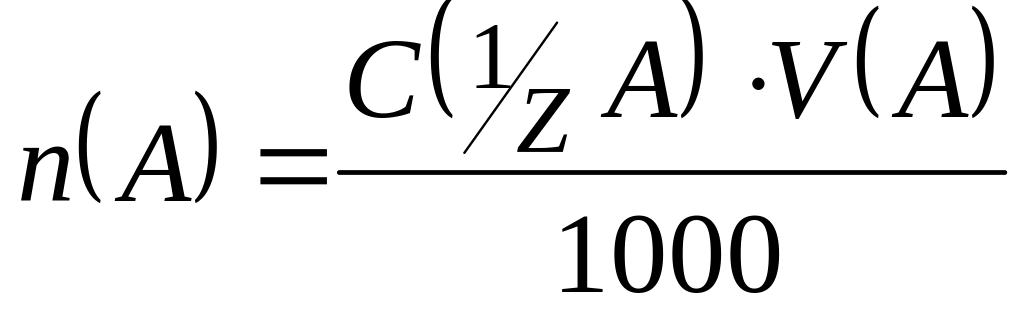 ;
;
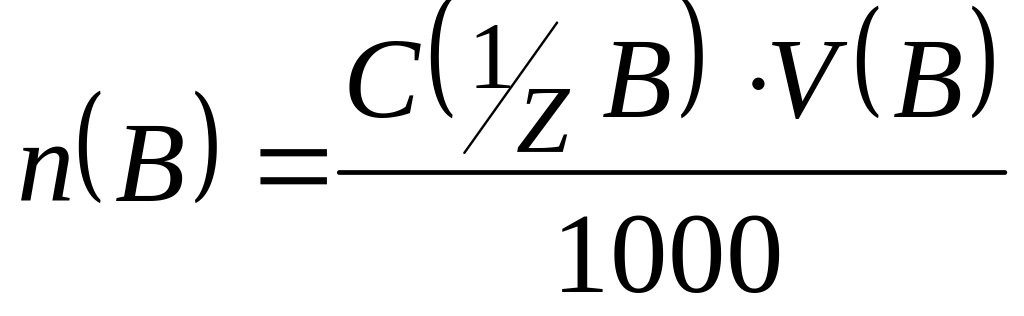 ,
то
,
то
![]() ,
звідси
,
звідси
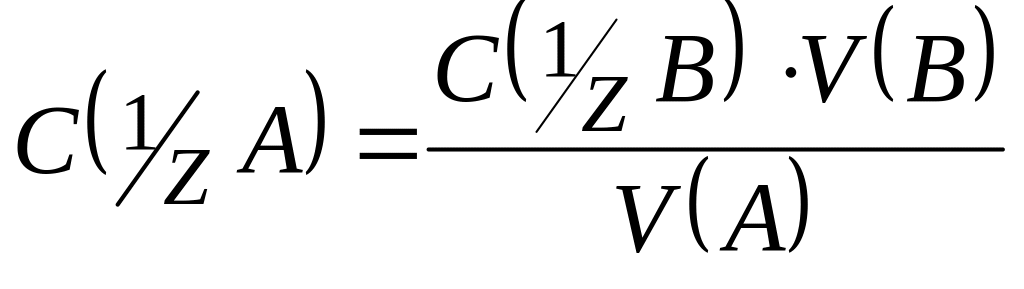 .
.
2. Якщо концентрація робочого розчину речовини В виражена через T(B), то нормальну концентрацію С( A) визначають із рівності:
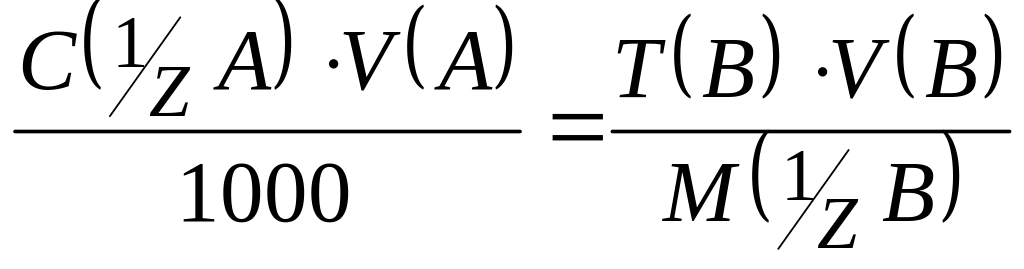 ;
;
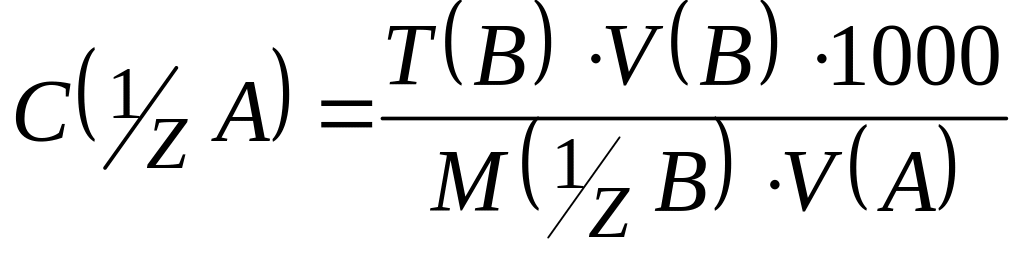 .
.
3. Якщо концентрація робочого розчину речовини В виражена в грамах визначуваної речовини А, тобто через T(B/A), тоді нормальну концентрацію розчину А знаходять за такою послідовністю: спочатку знаходять T(B):
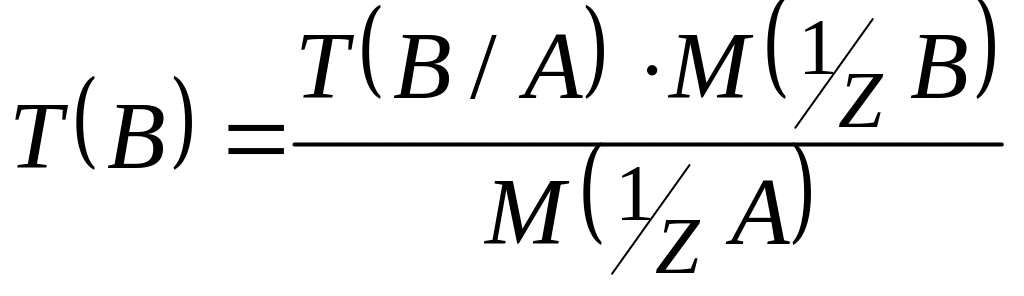 ,
,
а потім знаходять нормальну концентрацію C( A):
.
4. При визначенні маси речовини А за результатами титрування всієї кількості речовини А, коли відома концентрація робочого розчину В i об'єм V(B), у залежності від способу вираження концентрації розчину В, використовують наступні формули:
а) концентрація робочого розчину В виражена через нормальну концентрацію C( B):
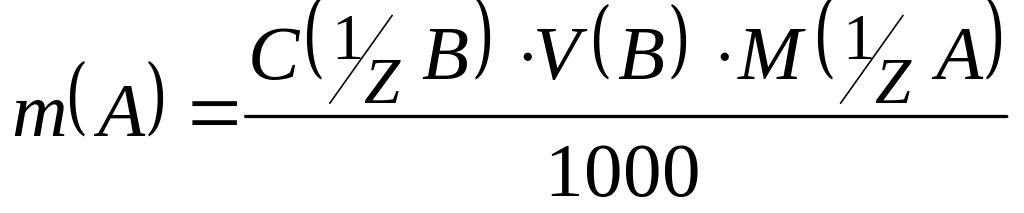 ,
,
б) концентрація робочого розчину В виражена через титр T(B):
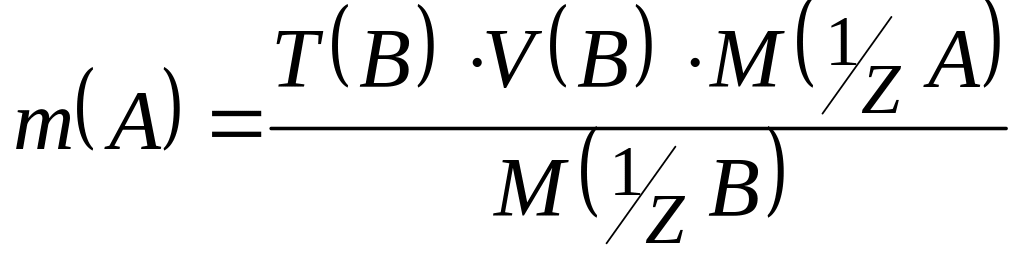 ,
,
в) концентрація робочого розчину виражена через титр, виражений у грамах визначуваної речовини:
![]() .
.
Коли ж титрується не вся кількість визначуваної речовини, а лише частка її, яка міститься в алiквотнiй частці розчину, враховують співвідношення Vк/Vп, (де Vк об'єм мірної колби, Vп об'єм піпетки). Розчин у титриметричному аналізі часто характеризують молярною концентрацією еквівалента з поправковим коефіцієнтом. Поправковий коефіцієнт (К) дорівнює відношенню істинної молярної концентрації еквівалента робочого розчину до табличної молярної концентрації еквівалента (для якої можна заздалегідь розрахувати, якій масі речовини, що визначають, відповідає 1 мл робочого розчину):
К = Сіст /Стабл.
