
- •Механика
- •Кинематика
- •Динамика
- •Статика
- •Статика твердого тела
- •Статика жидкостей и газов
- •Молекулярная физика
- •Броуновское движение
- •Уравнение Клапейрона:
- •Уравнение Менделеева – Клапейрона
- •Термодинамика
- •Агрегатные состояния вещества
- •Электростатика
- •Электрическое взаимодействие тел и его особенности
- •Электростатическое поле
- •1. Проводники (металлы) в электрическом поле
- •2. Диэлектрики в электрическом поле
- •Электрическая емкость
- •Конденсаторы
- •Электродинамика
- •Электрический ток
- •Электрический ток в разных средах
- •Ток в газе
- •Ток в вакууме
- •Магнетизм
- •Явление электромагнитной индукции
- •Колебания и волны
- •Понятие колебания
- •Электрические колебания
- •Геометрическая (лучевая) оптика
- •Волновая оптика
- •Современная физика
- •Атомная и ядерная физика
- •Метода регистрации ионизирующих излучений
- •Приложение Основные и дополнительные величины си и их единицы
Агрегатные состояния вещества
Разновидности упорядоченности
(на примерах воды и льда)
В газе (паре) расположение молекул неупорядочено.
В жидкости расположение молекул не беспорядочно: в большинстве жидкостей есть ближний порядок а в некоторых – даже дальний.
Каждую молекулу воды окружают 5 – 6 соседних, расположенных в основном в вершинах неправильного пятиугольника. Вблизи другой молекулы соседние молекулы тоже образуют пятиугольник, но иной формы.
Порядок в расположении молекул вещества, соблюдающийся только вблизи данной молекулы, - ближний порядок.
В твердых телах (монокристаллах) упорядоченность – в пределах всего вещества, т.е. дальний порядок.
Испарение жидкостей и конденсация пара
Испарение – парообразование со свободной поверхности жидкости, конденсация – обратный процесс, т.е. образование жидкости из пара. (Образование инея, снега – тоже конденсация). Если испарение преобладает над конденсацией, пар ненасыщенный. При взаимном уравновешивании этих процессов пар насыщенный.
Чем
больше
,
тем больше
![]() .
.
Если
жидкость испаряется в замкнутом
пространстве,
![]() можно измерять манометром. Давление
водяного пара, содержащегося в воздухе,
измерить нельзя. Это давление (парциальное
давление, от «part»)
составляет часть измеряемого барометром
давления.
можно измерять манометром. Давление
водяного пара, содержащегося в воздухе,
измерить нельзя. Это давление (парциальное
давление, от «part»)
составляет часть измеряемого барометром
давления.
Кипение



- - - - - - - - - - - - - - -
- - - - - - - - - - - - - -
- - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - -
Это парообразование внутри жидкости. В этом процессе участвуют находящиеся в жидкости газовые пузырьки. Кипение жидкости при неизменном давлении происходит при строго определенной неизменной температуре. Чем больше давление над жидкостью, тем больше температура кипения.
Влажность воздуха. Точка росы
Абсолютная влажность – это парциальное давление пара в воздухе или плотность этого пара.
Относительная влажность :
![]() -
-
это отношение парциального давления пара (или плотности пара) к давлению (или плотности) насыщенного пара при данной температуре.
Точка росы – это температура, при которой находящийся в воздухе пар становится насыщенным.
Смачивание. Капиллярные явления

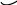


 =
= = = = =
=
= = = = =


 =
= = = =
=
= = = =
= = = = = = = = = = = = =
= = = = = = = = = = =
= = = = = = = = = = = =
= = = = = = = = = = = = = = =
а) б)
Смачивая
стеклянные стенки капилляра, жидкость
поднимается в капилляре на высоту
,
образуя вогнутый мениск, и приподнимается
около внешних стенок (а). Несмачивающая
жидкость опускается в капилляр и отходит
от внешних стенок, мениск при этом
выпуклый (б). Из условия :
![]() высота поднятия жидкости в капилляре
высота поднятия жидкости в капилляре
![]() ,
,
где - поверхностное натяжение жидкости, - ее плотность, - радиус капилляра. Капиллярность очень важна в живом мире (движение влаги в почве, движение питательных соков в растениях) и в технике (подъем спирта или керосина в фитиле, окрашивание тканей и кожи).
Твердые тела
Истинно твердые тела – кристаллы. В пределах всего тела дальний порядок сохраняется только в монокристаллах (условное строение монокристалла – кубики, сложенные в один большой куб). В природе монокристаллы редки, чаще встречаются поликристаллы. Они состоят из множества маленьких монокристаллов (кристаллов, зерен), расположенных неупорядочено друг относительно друга (модель поликристалла – не сложенные, а насыпанные кубики).
Кристаллическая решетка. Элементарная ячейка










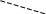


Кубическая Гексагональная
ячейка ячейка
Условное изображение дальнего порядка в монокристалле – решетка, в узлах которой - атомы. Наименьшее образование, многократным повторением которого можно получить монокристалл, - элементарная ячейка. Наиболее распространенными в природе являются кубическая (у железа, алюминия, каменной соли) и гексагональная (у цинка, магния, кадмия).
Анизотропия
Это
неодинаковость большинства физических
свойств вещества (за исключением
теплоемкости и плотности) в различных
направлениях. Если провести по две
прямые через центры ближайших атомов
в различных направлениях (1, 2, 3, 4), то
расстояния между каждой парой прямых
(а, значит, и между соответствующими
атомными плоскостями) окажутся различными:
и
-максимальны,
![]() -
минимально. Следовательно, прочность
монокристалла (связь между молекулами)
была бы минимальной при воздействии на
него в направлениях 1 и 2. Поликристаллы,
в отличие от монокристаллов, изотропны
(каждый кристаллит анизотропен, но
располагаются кристаллиты неупорядоченно).
-
минимально. Следовательно, прочность
монокристалла (связь между молекулами)
была бы минимальной при воздействии на
него в направлениях 1 и 2. Поликристаллы,
в отличие от монокристаллов, изотропны
(каждый кристаллит анизотропен, но
располагаются кристаллиты неупорядоченно).





![]()





 2
2




4 3
Жидкие кристаллы
Это жидкости с дальним порядком в расположении молекул.
В отличие от твердых кристаллов, в жидких кристаллах дальний порядок наблюдается только в одном направлении.
Известно более 3 000 различных жидких кристаллов, многие из них биологического происхождения.
Примечание: цифровая индикация (в том числе и часах), преобразование инфракрасного излучения в видимое; получение плоских экранов мониторов; термоиндикация; ультразвуковая медицинская диагностика вместо рентгеновской.
Аморфные тела
Так называют многие вещества (различные смолы, воск, стекло, пластмассы), обладающие ближним порядком. По структуре такие вещества – жидкости (очень вязкие).
Плавление
При нагревании кристаллического вещества увеличивается амплитуда колебаний его молекул, растет хаотичность их движения, и при достаточно высокой температуре исчезает дальний порядок (вещество плавится). Химически простые кристаллы плавятся при строго определенной температуре (точка плавления). Обратный процесс – кристаллизация.
Рассмотрим
нагрев кристаллического вещества.
Интервал
![]() - нагрев тела;
- нагрев тела;
![]() - плавление тела
- плавление тела
![]() ;
;
![]() - нагрев расплава;
- нагрев расплава;
![]() - кипение расплава
- кипение расплава
![]() .
.

![]()
![]()


![]()
![]()
![]()


 0
0
![]()
У сплавов существует интервал температур, в котором происходит плавлении е. Аморфные тела не плавятся, а размягчаются (уменьшается их вязкость), они не имеют .
Теплофизические характеристики вещества
1. Удельная теплоемкость
Чем
больше масса нагреваемого вещества и
чем большего изменения температуры
![]() нужно достичь, тем большего времени
требуется, и чем большее количество
теплоты нужно подвести к веществу:
нужно достичь, тем большего времени
требуется, и чем большее количество
теплоты нужно подвести к веществу:
![]() .
.
Для
различных веществ одинаковой массы
![]() для достижения одинаковых изменений
температур
для достижения одинаковых изменений
температур
![]() требуется различное количество теплоты
требуется различное количество теплоты
![]() :
:
![]() .
.
Коэффициент (от «capacity» - емкость) – удельная теплоемкость.
![]() .
.
Эта величина численно равна количеству теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К.
2. Удельная теплота плавления
Чем больше масса расплавляемого вещества, тем большее количество теплоты требуется, чтобы его расплавить:
![]() .
.
Удельная теплота плавления численно равна количеству теплоты, которое необходимо передать одному килограмму кристаллического вещества, нагретого до температуры плавления, чтобы превратить его в жидкость той же температуры.
Для процесса кристаллизации
![]() ,
,
в этом
случае
![]() - удельная теплота кристаллизации.
- удельная теплота кристаллизации.
3. Удельная теплота парообразования
Как и
в предыдущем случае,
![]() (чем жидкости больше, тем дольше ее
испарять, тем большее количество теплоты
требуется).
(чем жидкости больше, тем дольше ее
испарять, тем большее количество теплоты
требуется).
![]() .
.
Удельная теплота парообразования численно равна количеству теплоты, необходимому, чтобы при постоянной температуре 1 кг жидкости превратить в пар.
Для процесса конденсации
![]() ,
,
в этом
случае
![]() - удельная теплота конденсации.
- удельная теплота конденсации.
4. Удельная теплота сгорания (теплотворная способность).
Чем больше сгорает топлива, тем больше тепловыделение: . Различные вещества выделяют различное количество теплоты :
![]() .
.
Удельная теплота сгорания численно равна количеству теплоты, выделяющемуся при сгорании 1кг вещества.
Уравнение теплового баланса
Оно выражает закон сохранения энергии в процессах теплообмена.
Для тел, находящихся в тепловом контакте:
![]() .
.
(![]() для тел, получающих тепло,
для тел, получающих тепло,
![]() для тел, отдающих тепло).
для тел, отдающих тепло).
