
- •Общая и неорганическая химия
- •Часть 1
- •1. Основные классы неорганических соединений. Электролитическая диссоциация и ионные уравнения
- •2. Основные понятия и основные законы химии
- •Контрольные задания
- •3. Строение атома. Электронные формулы атомов
- •4. Периодический закон и периодическая система элементов д. И. Менделеева
- •5. Химическая связь
- •6. Химическая термодинамика. Энергетика химических процессов
- •7. Направленность химических процессов
- •8 Скорость химических реакций
- •9. Химическое равновесие
- •10. Растворы
- •10.1. Способы выражения концентрации растворов
- •1. Расчёт массовой доли раствора проводим по формуле (10.1):
- •10.2 Растворы электролитов
- •Контрольные задания
- •10.3 Растворы неэлектролитов
- •Приложение
- •Общая и неорганическая химия
- •Часть 1
- •357108 Г. Невинномысск, ул. Гагарина, 1
Контрольные задания
21.
Вычислите эквивалент и эквивалентную
массу фосфорной
кислоты
![]() в реакциях образования: а) гидрофосфата;
б) дигидрофосфата; в)
фосфата.
в реакциях образования: а) гидрофосфата;
б) дигидрофосфата; в)
фосфата.
22. Чему равен при нормальных условиях эквивалентный объем кислорода? На сжигание 3 г металла (+2) требуется 1,38 дм3 кислорода (н.у.). Вычислить эквивалентную массу и мольную массу этого металла. Ответ: 12,15 г/моль; 24,3 г/моль.
23. При сгорании 10,00 г металла образуется 18,88 г оксида металла. Определите эквивалентную массу металла. Ответ: 9,01 г/моль.
24. Масса 1 дм3 кислорода равна 1,4 г. Сколько дм3 кислорода расходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моль? Ответ: 10 дм3.
25.
В
какой массе
![]() содержится столько же эквивалентов,
сколько в 174 г
содержится столько же эквивалентов,
сколько в 174 г
![]() Ответ:
206
г.
Ответ:
206
г.
26.
Одинаков ли эквивалент хрома в соединениях
![]() и
эквивалентная масса железа в соединениях
и
эквивалентная масса железа в соединениях
![]() Дать
мотивированный ответ.
Дать
мотивированный ответ.
27. Определите эквивалентные массы металла и серы, если 3,24 г металла образуют 3,48 г оксида и 3,72 г сульфида.
Ответ: 108 г/моль и 16,0 г /моль.
28. Из 6,62 г нитрата металла получается 5,56 г его хлорида. Вычислить эквивалентную массу этого металла. Ответ: 103,6 г/моль.
29. При взаимодействии 6,48 г трехвалентного металла с кислотой выделяется 8,06 дм3 водорода (н.у.). Вычислить эквивалентную и мольную массу металла. Ответ: 9 г/моль, 27 г/моль.
30. На восстановление 1,8 г оксида металла пошло 833 см3 водорода при н.у. Вычислите эквивалентные массы оксида и металла.
Ответ: 24,2 г/моль, 16,2 г/моль.
31.
Элемент образует ряд газообразных
соединений, плотность которых по водороду
8, 15, 22, 29. Содержание элемента в данных
соединениях соответственно равно 75,0;
80,0; 81,81 и 82,76 %. Определите относительную
атомную массу и название элемента.
Ответ:
![]()
32. Элемент образует ряд газообразных соединений, относительные молекулярные массы которых равны 16, 44, 46 и 58. Содержание элемента в них соответственно составляет 75,0; 27,4; 52,2 и 62,0 %. Определите относительную атомную массу и название элемента. Ответ:
33. Элемент образует ряд легколетучих и газообразных соединений, плотность которых по водороду 13, 14, 39, 37. Содержание элемента в этих соединениях равно 92,31; 42,86; 92,31 и 64,86 %. Определите относительную атомную массу и название элемента. Ответ: 12; С.
34.
Элемент
образует ряд газообразных соединений,
относительные молекулярные массы
которых 36,45; 103,50; 133,33 и 74,55. Содержание
элемента в них равно 97,25; 68,50; 79,76 и 47,55 %.
Определите относительную атомную массу
и название элемента. Ответ:![]()
35.
На
окисление 1,5326 г металла расходуется
0,28 дм3
кислорода (н. у.). Удельная теплоемкость
металла 0,138 кДж/(моль∙К). Определите
точную относительную атомную массу
металла и назовите его. Атомная
теплоемкость 26,36 кДж/(моль∙К). Ответ:
![]()
36.
Удельная
теплоемкость металла 0,385 кДж/(моль∙К).
Определите точную относительную атомную
массу металла, если его молярная масса
эквивалента равна 32,68 г/моль. Назовите
его. Какова средняя масса одного атома
этого металла в граммах. Атомная
теплоемкость 26,36 кДж/(моль∙К). Ответ:![]() 1,08·10-22
г.
1,08·10-22
г.
37. Сульфид металла содержит 66,48 % металла, удельная теплоемкость которого 0,381 кДж/(моль∙К). Определите точную относительную атомную массу металла. Молярная масса эквивалента серы в сульфидах равна 16,03 г/моль. Атомная теплоемкость 26,36 кДж/(моль∙К). Вычислите среднюю массу одного атома этого металла в гpаммах. Ответ: 1,05·10-22 г.
38.
Оксид
металла (1,32 г) содержит 0,16 г кислорода.
Удельная теплоёмкость металла 0,117
кДж/(моль∙К). Атомная теплоемкость 26,36
кДж/(моль∙К). Определите точную
относительную атомную массу металла.
Назовите его. Какова средняя масса
одного атома этого металла в граммах?
Атомная теплоемкость 26,36 кДж/(моль∙К).
Ответ:
![]() 232; 3,85·10-22
г.
232; 3,85·10-22
г.
39.
Вычислите
количество вещества эквивалента и
молярную массу эквивалента нитрата
дигидроксожелеза
![]() и дигидроарсената лития
и дигидроарсената лития
![]() в
реакциях, выражаемых уравнениями:
в
реакциях, выражаемых уравнениями:
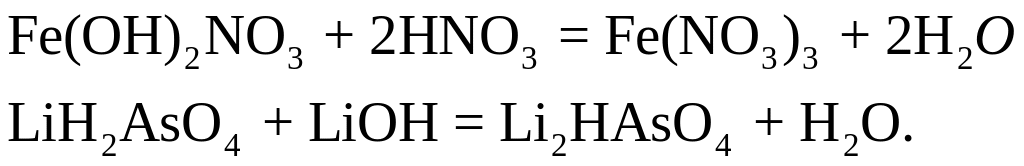
40. Вычислите количество вещества эквивалента и молярную массу эквивалента гидрокарбоната бария Ва(НСО3)2 и хлорида дигидроксогаллия Ga(ОН)2Сl в реакциях:

