
- •Міністерство освіти і науки україни
- •Плани подачі матеріалу
- •Лекція 1 Кінематика матеріальної точки
- •1.2 Основні кінематичні характеристики руху: траєкторія, переміщення, шлях, швидкість, прискорення. Зв’язок між ними.
- •1.3 Поступальний рух тіла. Рівномірний та рівноприскорений рухи. Рівномірний прямолінійний рух
- •1 . Визначення. Рівномірний прямолінійний рух - це такий рух, при якому тіло за рівні проміжки часу здійснює однакові переміщення.
- •1. Рівноприскорений прямолінійний рух - це такий рух при якому тіло за рівні проміжки часу змінює свою швидкість на однакову величину.
- •1.4 Вільний рух тіла в полі тяжіння Землі.
- •Прискорення вільного падіння g (ф.В.)
- •Переміщення при вільному падінні тіл
- •Звернути увагу!!!
- •Лекція 2 Основні поняття динамики
- •2.1. Взаємодія між тілами. Фундаментальні взаємодії. Поняття сили та маси. Сили у природі.
- •2.2 Сила пружності. Закон Гука. Механічна напруга Модуль пружності. Діаграма розтягу. Запас міцності. Крихкість. Пластичність
- •Механічна напруга (ф.В.)
- •Закон Гука
- •Діаграма розтягу тіл
- •2 .3 Сили тертя. Коефіцієнт тертя. Сила опору середовища. Сила тертя кочення
- •2.4 Закони Ньютона. Інерціальні системи відліку
- •2.5. Імпульс матеріальної точки. Імпульс сили. Закон збереження імпульсу. Центр мас системи. Рух центра мас.
- •Л екція 3. Робота та енергія
- •3.1 Механічна робота. Визначення роботи змінної сили через лінійний інтеграл. Потужність. Зв’язок між роботою та потужністю.
- •3.3 Кінетична енергія матеріальної точки. Теорема про зміну кінетичної енергії системи. Повна механічна енергія системи тіл. Закон збереження механічної енергії.
- •3.6 Пружні та не пружні зіткнення тіл
- •4.1 Обертання твердого тіла навколо нерухомої осі. Момент сили.
- •4.2 Момент інерції тіла. Теорема Штейнера.
- •4.3 Основний закон динаміки обертального руху. Умови рівноваги тіл
- •4.4 Момент імпульсу тіла, що здійснює обертання. Закон збереження моменту імпульсу
- •4.5 Робота й потужність моменту сили. Кінетична енергія обертального руху твердого тіла.
- •Лекція 5. Елементи механіки рідин
- •5.1 Гідростатика. Тиск в рідині. Закон Паскаля. Закон Архімеда
- •5.2 Гідроаеродинаміка. Ламінарна й турбулентна течія. Число Рейнольдса
- •5.3 Рівняння неперервності струменя рідини. Рівняння Бернуллі
- •5.4 Сила внутрішнього тертя. Закон Стокса. Динамічна в'язкість. Формула Пуазейля
- •Лекція 6. Фізичні основи молекулярно – кінетичної теорії
- •6.1. Поняття про статистичні й термодинамічні методи досліджень. Основні поняття мкт. Основні положення мкт й докази їх справедливості. Ідеальний газ
- •6.2 Мікроскопічні та термодинамічні параметри газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу. Середня кінетична енергія молекул.
- •6.3 Молекулярно-кінетичне тлумачення абсолютної температури. Рівняння Клапейрона-Менделєєва.
- •6.4 Розподіл швидкостей молекул за Максвелом
- •6 .5 Ефективний діаметр молекул. Середня довжина вільного пробігу молекул.
- •7.1 Явища переносу в газах. Теплопровідність. Закон Фур'є. Коефіцієнт теплопровідності газів.
- •7.2 Явище самодифузії. Закон Фіка. Коефіцієнт самодифузії
- •7.3 Внутрішнє тертя (в'язкість). Закон Ньютона для внутрішнього тертя. Коефіцієнт внутрішнього тертя. Зв'язок між коефіцієнтами для явища переносу
- •7.4 Внутрішня енергія. Внутрішня енергія ідеального газу. Ступені свободи молекул. Розподіл енергії молекул по ступенях свободи.
- •7.5 Теплота й робота. Перший закон термодинаміки.
- •7.6 Теплоємність ідеального газу в різних процесах. Рівняння Майєра
- •Лекція 8. Другий закон термодинаміки. Теплові двигуни
- •8.1 Оборотні процеси. Кругові процеси (цикли). Призначення і принцип дії теплових двигунів. Коефіцієнт корисної дії теплового двигуна.
- •8.2 Ентропія. Властивості ентропії. Ентропія ізольованої системи. Ентропія та ймовірність.
- •8.3 Другий закон термодинаміки. Теорема Карно. Цикл Карно. Наслідки теореми Карно.
- •Лекція 9. Реальні гази. Рідини. Тверді тіла
- •9.1 Особливості молекулярної будови газів, рідин, твердих тіл
- •Особливості молекулярної будови рідини
- •Особливості молекулярної будови твердих тіл
- •9.2 Критична температура. Пароутворення. Явище випаровування й конденсації. Явище кипіння.
- •9.3 Насичена пара. Властивості насиченої пари
- •9.4 Абсолютна та відносна вологість повітря
- •9.5 Явище поверхневого натягу рідин. Сили поверхневого натягу. Коефіцієнт поверхневого натягу. Явище змочування. Капілярні явища
- •Лекція 10. Електростатичне поле у вакуумі
- •10.1 Електричний заряд. Дискретність заряду. Електризація тіл. Закон збереження електричного заряду. Закон Кулона
- •Властивості електричних зарядів
- •Закон збереження заряду
- •Закон Кулона (1785р.)
- •10.2 Електричне поле. Напруженість електричного поля. Принцип суперпозиції. Поле системи зарядів
- •10.3. Потік вектора е. Теорема Остроградського-Гауса для потоку вектора е.
- •10.4 Напруженість електростатичного поля заряджених тіл
- •10.5 Робота сил поля. Потенціальність електростатичного поля. Потенціальна енергія заряду в полі.
- •10.6 Циркуляція вектора е. Властивості циркуляції вектора е електростатичного поля
- •10.7 Потенціал електричного поля. Робота по переміщенню заряду в електричному полі. Різниця потенціалів.
- •10.8 Принцип суперпозиції полів для потенціалу. Напруженість як градієнт потенціалу. Еквіпотенціальні поверхні
- •Лекція 11. Електричне поле в речовині
- •1 1.1 Електричний диполь. Напруженість і потенціал поля диполя. Диполь у зовнішньому електричному полі
- •11.2 Вільні та зв’язані електричні заряди. Поверхневі зв’язані заряди. Полярні та неполярні молекули. Поляризація діелектриків. Вектор поляризації.
- •11.3 Вектор поляризації. Зв'язок між p і е. Діелектрична сприйнятливість речовини
- •11.4 Умови рівноваги зарядів у провіднику. Потенціал провідника. Поле поблизу поверхні провідника. Розподіл зарядів по поверхні провідника. Електростатичний захист.
- •11.5 Електроємність провідника. Конденсатори. Ємність конденсатора. Енергія системи зарядів.
- •11.6 Енергія конденсатора. Енергія й об’ємна густина енергії електричного поля.
- •Лекція 12. Постійний електричний струм
- •12.1 Електричний струм, умови його існування. Сила та густина струму. Рівняння нерозривності. Закон Ома для ділянки кола в інтегральній та диференціальній формах.
- •12.2 Робота електричного струму. Закон Джоуля-Ленца в інтегральній та диференціальній формах. Потужність і к.К.Д. В колі постійного струму.
- •12.3 Узагальнений закон Ома в інтегральній формі. Електрорушійна сила. Закон Ома для повного кола
- •Лекція 13. Електричний струм у різних середовищах
- •13.1 Електричний струм у металах. Основні положення класичної електронної теорії. Швидкість упорядкованого руху електронів у металі.
- •13.2 Залежність опору провідника від температури. Температурний коефіцієнт електричного опору провідника. Явище надпровідності. Властивості провідників у надпровідному стані
- •Температурний коефіцієнт електричного опору провідника α (ф.В.)
- •13.3 Електричний струм у газах. Явище іонізації газу. Явище ударної іонізації газу. Електронна емісія. Плазма. Властивості плазми
- •Властивості плазми
- •13.4 Види самостійних електричних розрядів у газах. Тліючий розряд. Дуговий розряд. Іскровий розряд. Коронний розряд
- •Лекція 14. Магнітне поле. Магнітна індукція
- •14.1 Магнітна взаємодія струмів. Магнітне поле. Магнітна індукція
- •14.2 Магнітний момент. Вектор напруженості магнітного поля. Магнітна проникність речовини. Силові лінії магнітного поля (Лінії індукції магнітного поля)
- •1 4.3. Закон Біо-Савара-Лапласа. Напруженості магнітного поля окремих елементів зі струмом. Взаємодія паралельних струмів. Принцип суперпозиції. Закон Ампера.
- •14.4 Сила Лоренца. Дія магнітного поля на заряди, що рухаються. Ефект Холла.
- •14.5. Циркуляція вектора магнітної індукції. Теорема про циркуляцію вектора магнітної індукції в інтегральній формі. Магнітний потік. Теорема Гауса для вектора в.
- •14.6 Робота з переміщення провідника зі струмом у магнітному полі. Індуктивність контуру (статична)
- •Лекція 15. Електромагнітна індукція
- •15.1 Явище електромагнітної індукції. Закон електромагнітної індукції. Ерс провідника, що рухається в магнітному полі. Ерс індукції в нерухомих провідниках. Правило Ленца.
- •15.2 Явище самоіндукції. Індуктивність (динамічна) контуру. Перехідні процеси в колі з індуктивністю. Час релаксації.
- •15.3 Енергія контуру зі струмом. Енергія магнітного поля. Об’ємна густина енергії магнітного поля.
- •16.1 Гармонічні коливання. Представлення гармонічних коливань у тригонометричній формі. Представлення гармонічних коливань у вигляді векторної діаграми
- •16.2 Математичний маятник. Пружинний маятник. Основні характеристики коливань. Фаза коливань. Початкова фаза коливань. Циклічна частота коливань. Амплітуда коливань. Період коливань. Частота коливань
- •Фаза коливань j (ф.В.)
- •Початкова фаза коливань j0 (ф.В.)
- •Циклічна частота коливань ω (ф.В.)
- •Амплітуда коливань a (ф.В.)
- •Період коливань t (ф.В.)
- •Частота коливань (ню) (ф.В.)
- •16.2 Диференціальне рівняння вільних коливань лінійного гармонічного осцилятора. Затухаючі вільні коливання. Диференціальне рівняння затухаючих коливань
- •16.3 Логарифмічний декремент загасання. Енергія коливального руху. Добротність коливальної системи
- •1 6.4 Вимушені коливання. Диференціальне рівняння вимушених механічних коливань, аналіз його розв’язку. Амплітуда і фаза вимушених коливань.
- •16.5 Механічний резонанс. Добротність коливальної системи при резонансі
- •Лекція 17. Електромагнітні коливання
- •1 7.1. Електричний коливальний контур. Власні електромагнітні коливання.
- •17.2 Перетворення енергії в коливальному контурі. Виведення диференціального рівняння власних коливань. Формула Томсона
- •17.3 Диференціальне рівняння затухаючих електричних коливань та його розв’язок. Вимушені електричні коливання, їх диференціальне рівняння
- •17.4 Резонансні криві коливального контуру. Характеристичний (хвилевий) опір контуру. Добротність коливального контуру
- •Лекція 18. Механічні хвилі
- •18.1 Механічні хвилі. Рівняння плоскої хвилі. Хвильове число
- •18.2 Види хвиль. Характеристики хвиль. Властивості хвиль
- •18.3 Властивості механічних хвиль. Хвильовий вектор. Фазова швидкість. Групова швидкість хвилі
- •18.4 Енергія хвильового руху. Вектор Умова
- •18.5 Когерентність. Інтерференція хвиль. Стояча хвиля.
- •Л екція 19. Електромагнітні хвилі
- •19.1 Електромагнітні хвилі у вакуумі. Основні властивості електромагнітної хвилі.
- •Властивості електромагнітних хвиль
- •19.2 Шкала електромагнітних хвиль
- •1. Низькочастотні хвилі (змінний струм).
- •2. Радіохвилі
- •3. Інфрачервоне випромінювання
- •4. Видиме світло
- •5. Ультрафіолетове випромінювання
- •6. Рентгенівське випромінювання
- •7. Гамма випромінювання й космічні промені
- •19.2 Перенесення енергії електромагнітними хвилями. Вектор Пойнтінга
- •20.1 Фотометрія. Основні фотометричні величини і їх одиниці. Світлові величини.
- •Лекція 21. Хвильова оптика. Інтерференція світла
- •21.1 Світлові хвилі. Монохроматичність. Оптична різниця ходу. Когерентність хвиль
- •21.2 Явище інтерференції світла
- •21.3 Інтерференція від двох точкових джерел (дослід Юнга). Методи одержання інтерференційних картин: бідзеркало та біпризма Френеля, дзеркало Ллойда
- •21.4 Інтерференція на тонких плівках
- •21.5 Просвітлення оптики. Смуги рівної товщини і рівного нахилу. Інтерферометри. Кільця Ньютона
- •2 2.1 Явище дисперсії світла. Світло й кольори тіл
- •22.2 Явище поляризації світла. Поляризатори. Кут Брюстера
- •22.3 Закон Малюса. Оптично-активні середовища. Закон Біо
- •2 3.1 Явище дифракції світла. Зони Френеля
- •2 3.2 Дифракція Фраунгофера. Дифракція Фраунгофера на двох щілинах
- •2 3.3 Дифракція на отворі. Зони Френеля. Дифракція Фраунгофера на одній щілині
- •23.3 Дифракційна решітка. Дифракційний спектр. Роздільна здатність дифракційної решітки
- •23.4 Дифракція на просторовій решітці. Формула Вульфа-Брегга. Рентгеноструктурний аналіз
- •Лекція 24. Теплове випромінювання
- •24.1 Теплове випромінювання. Властивості теплового випромінювання
- •24.2 Основні характеристики теплового випромінювання. Енергетична світність тіла. Спектральна густина енергетичної світності. Коефіцієнт поглинання
- •24.3 Закон Стефана-Больцмана. Закон зміщення Віна
- •2 4.4 Ультрафіолетова катастрофа. Квантова гіпотеза випромінювання м. Планка
- •24.5 Оптична пірометрія. Радіаційна температура. Колірна температура. Температура яскравості
- •25.1 Енергія, маса та імпульс фотона
- •25.2 Фотоелектричний ефект. Явище внутрішнього фотоефекту
- •25.3 Явище зовнішнього фотоефекту. Рівняння а. Ейнштейна для фотоефекту. Робота виходу. Максимальна кінетична енергія фотоелектрона.
- •25.4 Закони фотоефекту
- •25.5 Ефект Комптона. Тиск світла. Досліди Лебедєва
- •25.6 Досліди Резерфорда. Ядерна модель атома Резерфорда. Труднощі ядерної моделі атома
- •25.7 Постулати Бора. Досліди Франка і Герца
- •25.8 Походження лінійчатих спектрів випромінювання атомів. Спектри випромінювання воднеподібних атомів. Формула Бальмера-Рідберга. Спектральні серії.
- •Література
7.5 Теплота й робота. Перший закон термодинаміки.
Робота газу при зміні його об'єму
Для розгляду конкретних процесів знайдемо в загальному вигляді зовнішню роботу, що здійснюється газом при зміні його об'єму. Розглянемо, наприклад, газ, що знаходиться під поршнем у циліндричній посудині (рисунок 7.6).
Я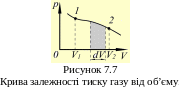 кщо
газ, розширюючись, пересуває поршень
на нескінченно малу відстань dl,
то над ним виконують роботу,
кщо
газ, розширюючись, пересуває поршень
на нескінченно малу відстань dl,
то над ним виконують роботу,
 ,
де S -
площа поршня; Sdl
= dV -
зміна об'єму системи. Повну виконану
газом роботу А,
при зміні його об'єму від V1
до V2,
знайдемо інтегруванням
,
де S -
площа поршня; Sdl
= dV -
зміна об'єму системи. Повну виконану
газом роботу А,
при зміні його об'єму від V1
до V2,
знайдемо інтегруванням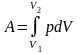 .
.
Знайдений для роботи вираз справедливий при будь-яких змінах об’єму твердих, рідких і газоподібних тіл. Отриману при тому чи іншому процесі роботу можна зобразити графічно за допомогою кривої в координатах р, V. Нехай зміна тиску газу при його розширенні зображується кривю на рисунку 7.7. При збільшенні об’єму на dV виконана газом робота дорівнює pdV, тобто визначається площею смужки з основою dV, тонованою на малюнку. Тому повна робота, що здійснюється газом при розширенні від об'єму V1 до об'єму V2, визначається площею, обмеженою віссю абсцис, кривою р = f (V) і прямими V1 та V2.
Перший закон термодинаміки
1. Перший закон термодинаміки встановлює, якими способами можна змінити внутрішню енергію ідеального газу. Внутрішню енергію можна змінити двома способами: а) теплопередачею, б) виконанням роботи. Наприклад: а) газ нагрівають за допомогою нагрівника, б) насосом накачують газ у балон, поршень насоса виконує роботу над газом і газ нагрівається.
Перший закон термодинаміки - це закон збереження енергії, сформульований для теплових процесів.
2. Закон формулюють для двох випадків: а) газ виконує роботу (газ розширюється), б) над газом виконують роботу (газ стискають).
а) Кількість теплоти Q, яка передана газу, іде на виконання газом роботи A й на зміну його внутрішньої енергії U.
б) Внутрішня енергія газу U змінюється за рахунок виконання над газом роботи A′ й передачі газу кількості теплоти Q.
3. а) Q = A + U б) U = A′ + Q
4. Закон застосовують для ідеального газу, що знаходиться в замкнутій системі.
7.6 Теплоємність ідеального газу в різних процесах. Рівняння Майєра
Застосування першого закону термодинаміки до ізопроцесів у газах
Визначення. Будь-яка зміна, яке відбувається в термодинамічній системі, називається термодинамічним процесом.
* Визначення. Ізопроцеси в газах - це процеси переходу незмінної маси газу з одного стану в інший при одному фіксованому макроскопічному параметрі.
Перший закон термодинаміки для ізобарного процесу
В изначення.
Ізобарний процес - це
процес переходу незмінної маси газу з
одного стану в інший при постійному
тиску (p = const).
изначення.
Ізобарний процес - це
процес переходу незмінної маси газу з
одного стану в інший при постійному
тиску (p = const).
За першим законом термодинаміки Q = A + ΔU.
При
ізобарному процесі змінюється температура
газу, тому відбувається зміна його
внутрішньої енергії:
 .
.
Оскільки в даному процесі змінюється об’єм, то й робота теж виконується A = pΔV. (На pV діаграмі (Рисунок 7.8) робота при ізобарному процесі - це площа прямокутника, площею графіка обмеженого ізобарою й координатами початкового й кінцевого об’єму)
Звідки
Q = A + ΔU,
або
 .
.
З
рівняння стану ідеального газу
отримуємо
 ,
звідки
,
звідки

При ізобарному процесі все підведене до газу тепло йде на виконання газом роботи і зміна внутрішньої енергії.
Величину
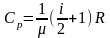 називають питомою
теплоємністю ідеального газу при
постійному тиску.
називають питомою
теплоємністю ідеального газу при
постійному тиску.
*Виведення формули роботи при ізобарному процесі
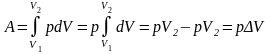
Перший закон термодинаміки для ізотермічного процесу
Визначення. Ізотермічний процес - це процес переходу незмінної маси газу з одного стану в інший при постійній температурі (T = const).
З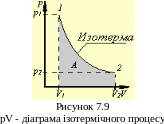 а
першим законом термодинаміки
а
першим законом термодинаміки
Q = A + ΔU.
При ізотермічному процесі температура газу залишається постійною, тобто ΔT = 0 Це означає, що зміна внутрішньої енергії відсутня, тобто ΔU = 0. Перший закон термодинаміки набуває вигляд: Q = A
При ізотермічному процесі все підведене до газу тепло йде на виконання газом роботи.
Для обчислення роботи газу при ізотермічного процесу можна скористатися графічним методом. На pV діаграмі ізотермічний процес має вигляд гілки гіперболи (Рисунок 7.9). Робота газу зображується площею графіка обмеженого ізотермою й координатами початкового й кінцевого об'єму.
*Виведення формули роботи при ізотермічному процесі
так як.
,
то
 ,
а
,
а
 Звідки
Звідки

Перший закон термодинаміки для ізохорного процесу
Визначення. Ізохоричний процес - це процес переходу незмінної маси газу з одного стану в інший при постійному об’ємі (V = const).
За першим законом термодинаміки Q = A + ΔU.
При ізохоричному процесі об'єм газу залишається постійним ΔV = 0. А це означає, що робота не виконується A = 0.
Передане в систему тепло йде на нагрівання газу, а це значить, що змінюється його внутрішня енергія.
Тому перший закон термодинаміки має вигляд: Q = ΔU або,
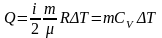 .
.
При ізохорному процесі все підведене до газу тепло йде на зміну внутрішньої енергії газу. (Газ нагрівається).
Величину
 називають питомою
теплоємністю ідеального газу при
постійному об’ємі.
називають питомою
теплоємністю ідеального газу при
постійному об’ємі.
Легко
зрозуміти, що


О станній
вираз називається рівнянням
Майера; він показує, що
Ср
завжди більше Cv
на величину
станній
вираз називається рівнянням
Майера; він показує, що
Ср
завжди більше Cv
на величину
 .
Це пояснюється тим, що для нагрівання
газу при постійному тиску потрібно ще
додаткову кількість теплоти на здійснення
роботи по розширенню газу.
.
Це пояснюється тим, що для нагрівання
газу при постійному тиску потрібно ще
додаткову кількість теплоти на здійснення
роботи по розширенню газу.
Адіабатний процес
Визначення. Адіабатний процес - це процес переходу незмінною маси газу з одного стану в інший без теплообміну з навколишнім середовищем. Тобто для адіабатного процесу: Q = 0 .
Щоб здійснити такий процес, потрібно помістити газ у теплоізольованому циліндрі з поршнем.
Близьким до адіабатних процесу є також процес швидкого стиснення або розширення газу.
За першим законом термодинаміки - Q = A + ΔU.
Врахувавши те, що Q = 0, отримаємо 0 = A + ΔU; звідки A = -ΔU
При адіабатному процесі газ виконує роботу за рахунок зміни внутрішньої енергії.
На
графіку адіабатний процес зображують
адіабати (рисунок 7.10). З рисунка видно,
що при однаковій зміні об’єму тиск газу
скоріше змінюється в адіабатному, ніж
ізотеричному процесі (для ізотермічного процесу
(для ізотермічного процесу
 ).
Це пояснюється тим, що під час адіабатного
процесу тиск газу змінюється як за
рахунок зміни об’єму, так і за рахунок
зміни температури, а при ізотермічному
процесі тиск змінюється тільки за
рахунок зміни об’єму.
).
Це пояснюється тим, що під час адіабатного
процесу тиск газу змінюється як за
рахунок зміни об’єму, так і за рахунок
зміни температури, а при ізотермічному
процесі тиск змінюється тільки за
рахунок зміни об’єму.
З формули A = -ΔU випливає, що адіабатне розширення газу призводить до зменшення його внутрішньої енергії (температура газу зменшується). Це використовується в холодильниках.
Адіабатне стиснення газу призводить до зростання його внутрішньої енергії (температура газу збільшується). Це явище використовується в дизельних двигунах для запалювання робочої суміші.
*Виведення формули роботи при адіабатному процесі
A
= -ΔU або

Зробивши
диференціювання рівняння стану для
ідеального газу
,
отримаємо -
 ,
,
знайдемо
відношення
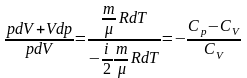 ,
,
звідки
 .
.
Величину
 називають постійною
адіабати.
називають постійною
адіабати.
Інтегруючи
рівняння
 в межах від р1
до р2
і відповідно від V1
до V2,
а потім потенціюючи, прийдемо до виразу
в межах від р1
до р2
і відповідно від V1
до V2,
а потім потенціюючи, прийдемо до виразу
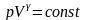 .
Отримане рівняння
називається рівнянням
Пуассона.
.
Отримане рівняння
називається рівнянням
Пуассона.
Якщо
газ адіабатно розширюється від об'єму
V1
до V2,
то його температура
зменшується від Т1
до Т2
і робота розширення
ідеального газу
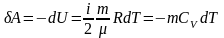 .
.
Запитання до лекції 7
1. Напишіть формулу для визначення маси речовини, що переноситься при дифузії.
2. Напишіть формулу для визначення сили внутрішнього тертя між шарами газу.
3. Напишіть формулу для визначення кількості теплоти, що переноситься при теплопровідності.
4. Напишіть формули, що визначають коефіцієнти дифузії, динамічної в’язкості (внутрішнього тертя) та теплопровідності в явищах переносу. Укажіть на зв'язок між ними.
5. Що Ви розумієте під внутрішньою енергією ідеального газу?
6. Як Ви розумієте перше начало термодинаміки? Напишіть відповідну формулу.
7. Дайте визначенню числу ступенів свободи молекули.
8. Чому дорівнює внутрішня енергія ідеального газу?
9. У чому полягає фізичний зміст універсальної газової постійної R?
10. У чому полягає ізотермічний процес? Чому дорівнює робота при ізотермічному процесі?
11. Застосуйте перше начало термодинаміки до ізохоричного процесу.
12. Дайте визначення питомої теплоємності газу при постійному об’ємі та напишіть відповідну формулу.
13. Застосуйте перше начало термодинаміки до ізобаричного процесу.
14. Дайте визначення питомої теплоємності газу при постійному тиску та напишіть відповідну формулу.
15. Напишіть рівняння Майєра та назвіть величини, що в нього входять.
16. У чому полягає адіабатичний процес?
17. Застосуйте перше начало термодинаміки до адіабатичного процесу.
18. Що таке постійна адіабати?
19. Як залежить показник адіабати від числа ступенів вільності молекул?
20. Напишіть формули для визначення роботи при адіабатичному процесі.
