
- •Міністерство освіти і науки україни
- •Плани подачі матеріалу
- •Лекція 1 Кінематика матеріальної точки
- •1.2 Основні кінематичні характеристики руху: траєкторія, переміщення, шлях, швидкість, прискорення. Зв’язок між ними.
- •1.3 Поступальний рух тіла. Рівномірний та рівноприскорений рухи. Рівномірний прямолінійний рух
- •1 . Визначення. Рівномірний прямолінійний рух - це такий рух, при якому тіло за рівні проміжки часу здійснює однакові переміщення.
- •1. Рівноприскорений прямолінійний рух - це такий рух при якому тіло за рівні проміжки часу змінює свою швидкість на однакову величину.
- •1.4 Вільний рух тіла в полі тяжіння Землі.
- •Прискорення вільного падіння g (ф.В.)
- •Переміщення при вільному падінні тіл
- •Звернути увагу!!!
- •Лекція 2 Основні поняття динамики
- •2.1. Взаємодія між тілами. Фундаментальні взаємодії. Поняття сили та маси. Сили у природі.
- •2.2 Сила пружності. Закон Гука. Механічна напруга Модуль пружності. Діаграма розтягу. Запас міцності. Крихкість. Пластичність
- •Механічна напруга (ф.В.)
- •Закон Гука
- •Діаграма розтягу тіл
- •2 .3 Сили тертя. Коефіцієнт тертя. Сила опору середовища. Сила тертя кочення
- •2.4 Закони Ньютона. Інерціальні системи відліку
- •2.5. Імпульс матеріальної точки. Імпульс сили. Закон збереження імпульсу. Центр мас системи. Рух центра мас.
- •Л екція 3. Робота та енергія
- •3.1 Механічна робота. Визначення роботи змінної сили через лінійний інтеграл. Потужність. Зв’язок між роботою та потужністю.
- •3.3 Кінетична енергія матеріальної точки. Теорема про зміну кінетичної енергії системи. Повна механічна енергія системи тіл. Закон збереження механічної енергії.
- •3.6 Пружні та не пружні зіткнення тіл
- •4.1 Обертання твердого тіла навколо нерухомої осі. Момент сили.
- •4.2 Момент інерції тіла. Теорема Штейнера.
- •4.3 Основний закон динаміки обертального руху. Умови рівноваги тіл
- •4.4 Момент імпульсу тіла, що здійснює обертання. Закон збереження моменту імпульсу
- •4.5 Робота й потужність моменту сили. Кінетична енергія обертального руху твердого тіла.
- •Лекція 5. Елементи механіки рідин
- •5.1 Гідростатика. Тиск в рідині. Закон Паскаля. Закон Архімеда
- •5.2 Гідроаеродинаміка. Ламінарна й турбулентна течія. Число Рейнольдса
- •5.3 Рівняння неперервності струменя рідини. Рівняння Бернуллі
- •5.4 Сила внутрішнього тертя. Закон Стокса. Динамічна в'язкість. Формула Пуазейля
- •Лекція 6. Фізичні основи молекулярно – кінетичної теорії
- •6.1. Поняття про статистичні й термодинамічні методи досліджень. Основні поняття мкт. Основні положення мкт й докази їх справедливості. Ідеальний газ
- •6.2 Мікроскопічні та термодинамічні параметри газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу. Середня кінетична енергія молекул.
- •6.3 Молекулярно-кінетичне тлумачення абсолютної температури. Рівняння Клапейрона-Менделєєва.
- •6.4 Розподіл швидкостей молекул за Максвелом
- •6 .5 Ефективний діаметр молекул. Середня довжина вільного пробігу молекул.
- •7.1 Явища переносу в газах. Теплопровідність. Закон Фур'є. Коефіцієнт теплопровідності газів.
- •7.2 Явище самодифузії. Закон Фіка. Коефіцієнт самодифузії
- •7.3 Внутрішнє тертя (в'язкість). Закон Ньютона для внутрішнього тертя. Коефіцієнт внутрішнього тертя. Зв'язок між коефіцієнтами для явища переносу
- •7.4 Внутрішня енергія. Внутрішня енергія ідеального газу. Ступені свободи молекул. Розподіл енергії молекул по ступенях свободи.
- •7.5 Теплота й робота. Перший закон термодинаміки.
- •7.6 Теплоємність ідеального газу в різних процесах. Рівняння Майєра
- •Лекція 8. Другий закон термодинаміки. Теплові двигуни
- •8.1 Оборотні процеси. Кругові процеси (цикли). Призначення і принцип дії теплових двигунів. Коефіцієнт корисної дії теплового двигуна.
- •8.2 Ентропія. Властивості ентропії. Ентропія ізольованої системи. Ентропія та ймовірність.
- •8.3 Другий закон термодинаміки. Теорема Карно. Цикл Карно. Наслідки теореми Карно.
- •Лекція 9. Реальні гази. Рідини. Тверді тіла
- •9.1 Особливості молекулярної будови газів, рідин, твердих тіл
- •Особливості молекулярної будови рідини
- •Особливості молекулярної будови твердих тіл
- •9.2 Критична температура. Пароутворення. Явище випаровування й конденсації. Явище кипіння.
- •9.3 Насичена пара. Властивості насиченої пари
- •9.4 Абсолютна та відносна вологість повітря
- •9.5 Явище поверхневого натягу рідин. Сили поверхневого натягу. Коефіцієнт поверхневого натягу. Явище змочування. Капілярні явища
- •Лекція 10. Електростатичне поле у вакуумі
- •10.1 Електричний заряд. Дискретність заряду. Електризація тіл. Закон збереження електричного заряду. Закон Кулона
- •Властивості електричних зарядів
- •Закон збереження заряду
- •Закон Кулона (1785р.)
- •10.2 Електричне поле. Напруженість електричного поля. Принцип суперпозиції. Поле системи зарядів
- •10.3. Потік вектора е. Теорема Остроградського-Гауса для потоку вектора е.
- •10.4 Напруженість електростатичного поля заряджених тіл
- •10.5 Робота сил поля. Потенціальність електростатичного поля. Потенціальна енергія заряду в полі.
- •10.6 Циркуляція вектора е. Властивості циркуляції вектора е електростатичного поля
- •10.7 Потенціал електричного поля. Робота по переміщенню заряду в електричному полі. Різниця потенціалів.
- •10.8 Принцип суперпозиції полів для потенціалу. Напруженість як градієнт потенціалу. Еквіпотенціальні поверхні
- •Лекція 11. Електричне поле в речовині
- •1 1.1 Електричний диполь. Напруженість і потенціал поля диполя. Диполь у зовнішньому електричному полі
- •11.2 Вільні та зв’язані електричні заряди. Поверхневі зв’язані заряди. Полярні та неполярні молекули. Поляризація діелектриків. Вектор поляризації.
- •11.3 Вектор поляризації. Зв'язок між p і е. Діелектрична сприйнятливість речовини
- •11.4 Умови рівноваги зарядів у провіднику. Потенціал провідника. Поле поблизу поверхні провідника. Розподіл зарядів по поверхні провідника. Електростатичний захист.
- •11.5 Електроємність провідника. Конденсатори. Ємність конденсатора. Енергія системи зарядів.
- •11.6 Енергія конденсатора. Енергія й об’ємна густина енергії електричного поля.
- •Лекція 12. Постійний електричний струм
- •12.1 Електричний струм, умови його існування. Сила та густина струму. Рівняння нерозривності. Закон Ома для ділянки кола в інтегральній та диференціальній формах.
- •12.2 Робота електричного струму. Закон Джоуля-Ленца в інтегральній та диференціальній формах. Потужність і к.К.Д. В колі постійного струму.
- •12.3 Узагальнений закон Ома в інтегральній формі. Електрорушійна сила. Закон Ома для повного кола
- •Лекція 13. Електричний струм у різних середовищах
- •13.1 Електричний струм у металах. Основні положення класичної електронної теорії. Швидкість упорядкованого руху електронів у металі.
- •13.2 Залежність опору провідника від температури. Температурний коефіцієнт електричного опору провідника. Явище надпровідності. Властивості провідників у надпровідному стані
- •Температурний коефіцієнт електричного опору провідника α (ф.В.)
- •13.3 Електричний струм у газах. Явище іонізації газу. Явище ударної іонізації газу. Електронна емісія. Плазма. Властивості плазми
- •Властивості плазми
- •13.4 Види самостійних електричних розрядів у газах. Тліючий розряд. Дуговий розряд. Іскровий розряд. Коронний розряд
- •Лекція 14. Магнітне поле. Магнітна індукція
- •14.1 Магнітна взаємодія струмів. Магнітне поле. Магнітна індукція
- •14.2 Магнітний момент. Вектор напруженості магнітного поля. Магнітна проникність речовини. Силові лінії магнітного поля (Лінії індукції магнітного поля)
- •1 4.3. Закон Біо-Савара-Лапласа. Напруженості магнітного поля окремих елементів зі струмом. Взаємодія паралельних струмів. Принцип суперпозиції. Закон Ампера.
- •14.4 Сила Лоренца. Дія магнітного поля на заряди, що рухаються. Ефект Холла.
- •14.5. Циркуляція вектора магнітної індукції. Теорема про циркуляцію вектора магнітної індукції в інтегральній формі. Магнітний потік. Теорема Гауса для вектора в.
- •14.6 Робота з переміщення провідника зі струмом у магнітному полі. Індуктивність контуру (статична)
- •Лекція 15. Електромагнітна індукція
- •15.1 Явище електромагнітної індукції. Закон електромагнітної індукції. Ерс провідника, що рухається в магнітному полі. Ерс індукції в нерухомих провідниках. Правило Ленца.
- •15.2 Явище самоіндукції. Індуктивність (динамічна) контуру. Перехідні процеси в колі з індуктивністю. Час релаксації.
- •15.3 Енергія контуру зі струмом. Енергія магнітного поля. Об’ємна густина енергії магнітного поля.
- •16.1 Гармонічні коливання. Представлення гармонічних коливань у тригонометричній формі. Представлення гармонічних коливань у вигляді векторної діаграми
- •16.2 Математичний маятник. Пружинний маятник. Основні характеристики коливань. Фаза коливань. Початкова фаза коливань. Циклічна частота коливань. Амплітуда коливань. Період коливань. Частота коливань
- •Фаза коливань j (ф.В.)
- •Початкова фаза коливань j0 (ф.В.)
- •Циклічна частота коливань ω (ф.В.)
- •Амплітуда коливань a (ф.В.)
- •Період коливань t (ф.В.)
- •Частота коливань (ню) (ф.В.)
- •16.2 Диференціальне рівняння вільних коливань лінійного гармонічного осцилятора. Затухаючі вільні коливання. Диференціальне рівняння затухаючих коливань
- •16.3 Логарифмічний декремент загасання. Енергія коливального руху. Добротність коливальної системи
- •1 6.4 Вимушені коливання. Диференціальне рівняння вимушених механічних коливань, аналіз його розв’язку. Амплітуда і фаза вимушених коливань.
- •16.5 Механічний резонанс. Добротність коливальної системи при резонансі
- •Лекція 17. Електромагнітні коливання
- •1 7.1. Електричний коливальний контур. Власні електромагнітні коливання.
- •17.2 Перетворення енергії в коливальному контурі. Виведення диференціального рівняння власних коливань. Формула Томсона
- •17.3 Диференціальне рівняння затухаючих електричних коливань та його розв’язок. Вимушені електричні коливання, їх диференціальне рівняння
- •17.4 Резонансні криві коливального контуру. Характеристичний (хвилевий) опір контуру. Добротність коливального контуру
- •Лекція 18. Механічні хвилі
- •18.1 Механічні хвилі. Рівняння плоскої хвилі. Хвильове число
- •18.2 Види хвиль. Характеристики хвиль. Властивості хвиль
- •18.3 Властивості механічних хвиль. Хвильовий вектор. Фазова швидкість. Групова швидкість хвилі
- •18.4 Енергія хвильового руху. Вектор Умова
- •18.5 Когерентність. Інтерференція хвиль. Стояча хвиля.
- •Л екція 19. Електромагнітні хвилі
- •19.1 Електромагнітні хвилі у вакуумі. Основні властивості електромагнітної хвилі.
- •Властивості електромагнітних хвиль
- •19.2 Шкала електромагнітних хвиль
- •1. Низькочастотні хвилі (змінний струм).
- •2. Радіохвилі
- •3. Інфрачервоне випромінювання
- •4. Видиме світло
- •5. Ультрафіолетове випромінювання
- •6. Рентгенівське випромінювання
- •7. Гамма випромінювання й космічні промені
- •19.2 Перенесення енергії електромагнітними хвилями. Вектор Пойнтінга
- •20.1 Фотометрія. Основні фотометричні величини і їх одиниці. Світлові величини.
- •Лекція 21. Хвильова оптика. Інтерференція світла
- •21.1 Світлові хвилі. Монохроматичність. Оптична різниця ходу. Когерентність хвиль
- •21.2 Явище інтерференції світла
- •21.3 Інтерференція від двох точкових джерел (дослід Юнга). Методи одержання інтерференційних картин: бідзеркало та біпризма Френеля, дзеркало Ллойда
- •21.4 Інтерференція на тонких плівках
- •21.5 Просвітлення оптики. Смуги рівної товщини і рівного нахилу. Інтерферометри. Кільця Ньютона
- •2 2.1 Явище дисперсії світла. Світло й кольори тіл
- •22.2 Явище поляризації світла. Поляризатори. Кут Брюстера
- •22.3 Закон Малюса. Оптично-активні середовища. Закон Біо
- •2 3.1 Явище дифракції світла. Зони Френеля
- •2 3.2 Дифракція Фраунгофера. Дифракція Фраунгофера на двох щілинах
- •2 3.3 Дифракція на отворі. Зони Френеля. Дифракція Фраунгофера на одній щілині
- •23.3 Дифракційна решітка. Дифракційний спектр. Роздільна здатність дифракційної решітки
- •23.4 Дифракція на просторовій решітці. Формула Вульфа-Брегга. Рентгеноструктурний аналіз
- •Лекція 24. Теплове випромінювання
- •24.1 Теплове випромінювання. Властивості теплового випромінювання
- •24.2 Основні характеристики теплового випромінювання. Енергетична світність тіла. Спектральна густина енергетичної світності. Коефіцієнт поглинання
- •24.3 Закон Стефана-Больцмана. Закон зміщення Віна
- •2 4.4 Ультрафіолетова катастрофа. Квантова гіпотеза випромінювання м. Планка
- •24.5 Оптична пірометрія. Радіаційна температура. Колірна температура. Температура яскравості
- •25.1 Енергія, маса та імпульс фотона
- •25.2 Фотоелектричний ефект. Явище внутрішнього фотоефекту
- •25.3 Явище зовнішнього фотоефекту. Рівняння а. Ейнштейна для фотоефекту. Робота виходу. Максимальна кінетична енергія фотоелектрона.
- •25.4 Закони фотоефекту
- •25.5 Ефект Комптона. Тиск світла. Досліди Лебедєва
- •25.6 Досліди Резерфорда. Ядерна модель атома Резерфорда. Труднощі ядерної моделі атома
- •25.7 Постулати Бора. Досліди Франка і Герца
- •25.8 Походження лінійчатих спектрів випромінювання атомів. Спектри випромінювання воднеподібних атомів. Формула Бальмера-Рідберга. Спектральні серії.
- •Література
6.3 Молекулярно-кінетичне тлумачення абсолютної температури. Рівняння Клапейрона-Менделєєва.
Температура Т (ф.в.)
1. Температура - це один з термодинамічних параметрів.
2. Визначення. Температура - це фізична величина, яка характеризує стан теплової рівноваги термодинамічної системи і є мірою середньої кінетичної енергії поступального руху молекул.
3. Температура - це скалярна величина.
4.
p=nkT;
 .
Де p
- тиск газу; n –
концентрація газу;
-
середня кінетична енергія поступального
руху молекул; Т
- температура
.
Де p
- тиск газу; n –
концентрація газу;
-
середня кінетична енергія поступального
руху молекул; Т
- температура
5. [Т]=К (Кельвін)
6. За 1 К прийнято 1/273,16 проміжку між абсолютним нулем і температурою потрійної точки води.
*Потрійна точка - це стан, при якому вода знаходиться одночасно в трьох фазах (твердій, рідкій і газоподібній).
7. Щоб виміряти температуру якого-небудь тіла, його необхідно привести в тепловий контакт з термометром. Термометр не повинен мати великої маси, бо масивний термометр змінить температуру досліджуваного тіла. Слід зазначити, що термометр фіксує свою власну температуру, яка дорівнює температурі тіла, з яким він знаходиться в тепловій рівновазі.
Шкала Цельсія
Шкала Цельсія виникла як результат праці багатьох учених світу в кінці 18 ст. За початок відліку цієї шкали вибрано температуру плавлення льоду при нормальному тиску, а одиницею вимірювання цієї шкали є градус Цельсія (°С). За 1 ˚С прийнято 1/100 проміжку між температурами плавлення льоду й температурою кипіння води при нормальному тиску. Цю шкалу використовують у повсякденному житті, але використовувати її для розв'язування задач не можна.
Абсолютна шкала температур (Шкала Кельвіна)
У Міжнародній системі одиниць прийнята абсолютна (термодинамічна) шкала температур. У ній за початок відліку вибрано найнижчу температуру, що існує у природі - абсолютний нуль температури.
Визначення. Абсолютний нуль температури - це температура, при якій відсутня кінетична енергія поступального руху молекул.
*Тому на абсолютній шкалі температур не існує від’ємних температур.
*Досягти абсолютного нуля неможливо. До нього лише можна наблизитися. Сьогодні отримують температури, що тільки на кілька мільйонних часток градуса вище абсолютного нуля.
О диницею
вимірювання цієї шкали є Кельвін (К).
диницею
вимірювання цієї шкали є Кельвін (К).
За 1К прийнято 1/273,16 проміжку між абсолютним нулем і температурою потрійної точки води.
Температура потрійної точки води по шкалі Цельсія - 0,16°С; по абсолютній шкалі - 273,16 К (Вибір такого числового значення температури потрійної точки води зроблений для того, щоб 1 К точно дорівнював 1°С. Тому між шкалою Цельсія й Кельвіна існує зв'язок. Т=273+t, але Dt=DT. На рисунку 6.1 схематично показана шкала Цельсія й абсолютна шкала температур.
Постійна Больцмана k (коефіцієнт)
1. Це коефіцієнт, що зв'язує температуру й середню кінетичну енергію поступального руху молекул.
2. Визначення. Постійна Больцмана - це величина, яка показує, на скільки зміниться кінетична енергія однієї молекули при зміні температури тіла на один Кельвін.
3. Це скалярна величина.
4. k=1,38·10-23 .
5. [k]=Дж/К.
Рівняння стану ідеального газу (Рівняння Менделєєва - Клапейрона)
1. Установлює залежність між макропараметрами ідеального газу.
2. Визначення. Для газу постійної маси об’єм, помножений на тиск і поділений на температуру, є постійною величиною.
3.
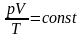 або
або
 ,
,
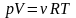 ,
де
,
де

4. Рівняння виведено для ідеального газу. Але його можна використовувати і для реальних газів в умовах близьких до нормальних. Проте застосовувати рівняння стану ідеального газу в умовах низької температури і великого тиску не можна, бо між молекулами газу прояв сил взаємодії стає більшим і виникає необхідність їх врахування.
Виведення рівняння стану ідеального газу
Відправляємося
від формули залежності тиску ідеального
газу від температури p=nkT;
 ;
;
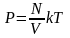 ;
;
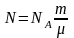 ;
;
 ;
;
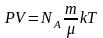 ;
R=kNA;
→
;
R=kNA;
→

Універсальна газова стала R
1. Це коефіцієнт пропорційності в рівнянні стану ідеального газу.
2. Визначення. Це робота, яку виконує один моль ідеального газу під час зміни його температури на 1 К при постійному тиску.
3. Це скалярна величина.
4. R=8,31
5. [R]=Дж/(моль·К).
Закон Дальтона
1. Установлює, чому дорівнює тиск суміші газів.
2. Визначення. Тиск суміші газів дорівнює сумі їх парціальних тисків.
3. p=p1+p2+…+pn
4.Застосовують для суміші газів за близьких до нормальних умов.
* Парціальний тиск - це тиск одного, окремо взятого від суміші, газу.
