
- •3.3. Ферриты
- •Ферритобразующие системы. Характерным примером систем данного типа является NiO-ZnO-Fe2o3.
- •Расчеты показывают, что ориентированная кристаллизация возможна при предельной разности параметров сопрягающихся решеток менее 18%.
- •В связи с этим с точки зрения термодинамического описания можно выделить 3 группы твердофазных реакций, в которых:
- •3.4. Твердые электролиты (суперионики)
- •Проводимость тэ со структурной разупорядоченностью
- •2 (А), 3 (б) и 4 (в). Число мест с указанной координацией
Основные типы ионных кристаллов. Ионные кристаллы обычно классифицируют в соответствии с их стехиометрическими коэффициентами. В табл. 3.4 и 3.5 приводятся структурные параметры ионных кристаллов типов МХ и МХ2.
Таблица 3.4 Структуры типа МХ
NaCl |
CsCl |
CuCl и ZnO |
NiAs |
Простейшая кубическая (каменная соль) 0,41<rk/rа0,7 КЧ 6:6 ОП |
Куби-ческая rk/rа > 0,73 КЧ 8:8 ОП |
Кубическая (сфалерит) Гексагональная (вюртцит) К и А образуют тетраэдры, отличающиеся положением в пространстве. КЧ 4:4 ТП |
Гексагональная (интерметаллиды переходных элементов) КЧ 6:6 ОП |
Таблица 3.5 - Структуры типа МХ2
СаF2 |
TiO2* |
CdI2 |
CdCl2 |
Кубическая (флюорит) rk/rа > 0,7 КЧ 8:4 ТП |
Гексагональная (рутил) или тетраэдрическая (анатаз) 0,7 > rk/rа > 0,4 КЧ 6:3 ОП |
Гексагональная (халькогениды, иодиды) КЧ 6:3 1/2ОП слоями |
Ромбоэдрическая (хлориды) КЧ 6:3 1/2ОП слоями |
* ТiO2 – типичный ионный кристалл, но его же можно рассматривать как неорганический полимер, поскольку известны гомологические ряды общей формулы TinO2n.
Структуры типа
M2Х3
(Al2O3)
или MMO3
(например,
перовскит FeTiO3).
В таких структурах ионы металла находятся
в ТП анионной (кислородной) подрешетки
(гексагональная ПУ). В структурах
соединений ММО3 сумма
зарядов М + М
= 6, rk
= rа.
Для описания этих структур используется
фактор стабильности
![]() ,
характеризующий компактность взаимного
расположения ионов. Для перовскита
t0
= 1, для FeTiO3
t0
= 0,71, для других кристаллов данного типа
t0
~ 0,8–1. К этому классу соединений относятся
многие промышленные диэлектрики, в
частности сегнетоэлектрики, которые
используются при изготовлении
конденсаторов, а также многие халькогениды
(например, слоистые кристаллы Sb2S3).
,
характеризующий компактность взаимного
расположения ионов. Для перовскита
t0
= 1, для FeTiO3
t0
= 0,71, для других кристаллов данного типа
t0
~ 0,8–1. К этому классу соединений относятся
многие промышленные диэлектрики, в
частности сегнетоэлектрики, которые
используются при изготовлении
конденсаторов, а также многие халькогениды
(например, слоистые кристаллы Sb2S3).
Структуры типа
шпинели.
Название происходит от минерала
"благородная шпинель" (MgAl2O4),
т.е.
![]() .
Шпинель имеет гранецентрированную
кубическую решетку и относится к
центросимметрической пространственной
группе m3m.
В образовании анионной подрешетки могут
участвовать галогены, кислород, халькогены
и псевдохалькогены (типа CN-группы), а
также фосфор и мышьяк. В качестве катионов
представлена подавляющая часть элементов
периодической системы, кроме наиболее
крупных катионов I–III групп и катионов
тяжелых металлов. Катионы расположены
как в тетраэдрических, так и в октаэдрических
пустотах. Примерами могут служить три
типа структур при комбинациях зарядов
катионов: М(2+)–M(3+)
(А); М(4+)–M(2+)
(В); М(6+)–M(5+)
(С). Составы шпинелей этих типов приведены
в табл. 3.6.
.
Шпинель имеет гранецентрированную
кубическую решетку и относится к
центросимметрической пространственной
группе m3m.
В образовании анионной подрешетки могут
участвовать галогены, кислород, халькогены
и псевдохалькогены (типа CN-группы), а
также фосфор и мышьяк. В качестве катионов
представлена подавляющая часть элементов
периодической системы, кроме наиболее
крупных катионов I–III групп и катионов
тяжелых металлов. Катионы расположены
как в тетраэдрических, так и в октаэдрических
пустотах. Примерами могут служить три
типа структур при комбинациях зарядов
катионов: М(2+)–M(3+)
(А); М(4+)–M(2+)
(В); М(6+)–M(5+)
(С). Составы шпинелей этих типов приведены
в табл. 3.6.
В шпинелях типа при плотной кубической упаковке в элементарной ячейке образуются 64 тетраэдрические и 32 октаэдрические пустоты (узлы), которые обозначают 8a и 16 ТП (16d), и в них размещаются 8 катионов M2+ и 16 катионов M3+.
Таблица 3.6 - Химический состав шпинелей разных типов
Тип шпинели |
М |
М |
Х |
А |
Mg, Ca, Zn, Cd, Hg, Sn, Mn, Fe, Co, Ni, Cu |
Al, Ga, In, Tl, V, Cr, Mn, Fe, Co, Ni, Rh |
O, S, Se, Te |
В |
Ge, Sn, Pb, Ti, V |
Mg, Zn, Mn, Fe, Co, Ni, Cu |
O, S |
С |
Mo, W |
Li, Na, Ag |
O |
Шпинели типа М[MM]X, в которых половина катионов M занимает ТП, а вторая половина M и все M – ОП, называют обращенными. В этом случае распределение катионов определяется симметрией химических связей. Например, ионы Zn2+ и Сd2+ всегда занимают ТП, при этом 4sp-электроны цинка и 5p-электроны кадмия образуют связь с шестью 2p-электронами ионов кислорода. Другие ионы, например Ni2+ или Cr3+, располагаются в ОП, что также связано с их электронным строением (наличием d-оболочки).
Эти особенности структуры учитываются при написании химических формул, например: нормальная шпинель MT[M2]OX4 (степень обращения = 0); обращенная шпинель MT[M,M2]OX4 ( = 1). Cмешанные шпинели типа M2+xFe3+(1–x)[M2+(1–x)Fe3+(1+x)]O4 являются твердыми растворами нормальных и обращенных шпинелей. Степень обращения шпинели [M0,33M0,67]T[M0,67M1,33]OO4 = 0,67.
В частности, структуру магнетита (Fe3O4) можно изобразить формулой Fe3+Т[Fe2+, Fe3+]ОО4. В ТП находятся только ионы Fe3+ (маленькие), а оставшаяся часть ионов Fe3+ и все ионы Fe2+ распределены статистически по ОП (узлам). Это соответствует случайному распределению N электронов по 2N валентным узлам. Валентная зона оказывается заполненной наполовину, а концентрация носителей сравнима с их концентрацией в металлах. Перенос осуществляется перескоком электрона с Fe2+ на Fe3+.
Шпинели, содержащие ионы железа (и другие ионы, обладающие высоким магнитным моментом ), называют феррит-шпинелями (ФШ). Ферримагнетизм шпинелей связан с расположением парамагнитных катионов вокруг анионов O2–.
Сверхобменное взаимодействие и антиферромагнетизм. Модель Нееля представляет собой структуру шпинели в виде двух антипараллельных магнитных подрешеток 8a и 16d. Основную роль в определении магнитных свойств играет антиферромагнитное взаимодействие 8aO2–16d. Взаимодействие спинов, приводящее к антиферромагнетизму, называется обменным.
Рассмотрим шпинели типа MFe2O4. Ион Ni2+ имеет 8d-электронов в октаэдрической координации. 2d-электрона распределяются на орбиталях, параллельных оси элементарной ячейки, ориентированы в направлении соседних ионов кислорода и переносятся на p-орбиталь кислородного иона. На каждой p-орбитали O2– имеются 2p-электрона, которые спарены антипараллельно. При взаимодействии Ni2+ и O2– образуется цепь взаимодействующих электронов, причем спины соседних Ni2+, разделенных ионами O2, ориентируются антипараллельно. Суммарный магнитный момент этих подрешеток = M16d – M8a. Ввиду отсутствия полного совпадения между экспериментальными и расчетными данными (табл. 3.7), в последующих моделях была учтена возможность образования в пределах каждой подрешетки двух подрешеток, расположенных под углом друг к другу.
При образовании
непрерывных твердых растворов нормальных
и обращенных шпинелей типа Zn2+x
Fe3+(1–x)
[M2+(1–x)Fe3+(1+x)]O4
Zn2+
всегда находится в узлах 8a
(ТП). Поэтому магнитный момент можно
подсчитать по формуле:
= M16d –
M8a
= 5(1 + x)
+ m(1
– x)
– 5(1 – x)
= 10x
+ (1 – x).
(m
– магнитный момент ионов М2+;
ионы Zn2+
собственного магнитного момента не
имеют;
![]() = 5В).
= 5В).
Таблица 3.7 - Намагниченность насыщения феррит-шпинелей
Шпинель |
Ионы в узлах |
Намагниченность
насыщения
|
||||
8a |
16d |
8a |
16d |
Расчет |
Эксперимент |
|
MnFe2O4 |
Fe3+0,2,Mn2+0,8 |
Mn2+, Fe3+ |
5 |
10 |
5 |
4,6 |
FeFe2O4 |
Fe3+ |
Fe2+, Fe3+ |
5 |
9 |
4 |
4,1 |
CoFe2O4 |
Fe3+ |
Co2+, Fe3+ |
5 |
8 |
3 |
3,7 |
Li0,5Fe2,5O4 |
Fe3+ |
Li+, Fe3+ |
5 |
7,5 |
2,5 |
2,6 |
CuFe2O4 |
Fe3+ |
Cu2+, Fe3+ |
5 |
6 |
1 |
1,3 |
NiFe2O4 |
Fe3+ |
Ni2+, Fe3+ |
5 |
7 |
2 |
2,3 |
MgFe2O4 |
Mg2+, Fe3+ |
Mg2+, Fe3+ |
4,5 |
5,5 |
1 |
1,1 |
Снижение при увеличении мольной доли немагнитного катиона определяется тем, что нарушается антипараллельность спиновых моментов и сверхобменное взаимодействие 8aO2–16d, т. к. ионы Zn2+ не имеют собственного .
В то время как все ферромагнетики – металлы, все антиферромагнетики – диэлектрики, однако их можно сделать проводниками путем легирования. Например, иод вызывает появление свободных электронов в антиферромагнитном диэлектрике EuSe, за счет чего при температуре жидкого гелия он становится полупроводником. Антиферромагнетиком является также Ln2CuO4, из которого посредством модифицирования были получены первые высокотемпературные сверхпроводники.
Энергия электронов проводимости в магнитных материалах зависит от типа магнитного упорядочения, и наоборот – электроны способны изменить магнитное упорядочение в антиферромагнетике. Электроны проводимости могут создавать в таких материалах ферромагнитные области в виде отдельных включений – капель. При этом возникает сверхкристалл из проводящих ферромагнитных капель в антиферромагнитном диэлектрике (рис. 3.1).


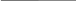



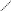
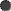
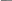





Рис. 3.1 - Структура сверхкристалла, образующегося при введении электронов в антиферромагнетик
С увеличением количества вводимых электронов объем ферромагнитных капель растет, они сливаются, после чего проводящая фаза становится основной и возникает сверхкристалл из изолирующих антиферромагнитных капель в ферромагнитном кристалле-проводнике. При нагревании такого соединения сначала плавится сверхкристалл. Так, если в антиферромагнитном кристалле была сверхструктура из ферромагнитных капель, то при нагревании он из изолятора превратится в проводник. Аналогичным образом на такой кристалл может действовать магнитное поле. Слабое поле может изменить тип сверхкристалла, а более сильное – даже привести к его плавлению. Под воздействием магнитного поля проводимость первого (ферромагнитного) кристалла изменится незначительно, а второго (антиферромагнитного) – изменится на 10 порядков.
Сверхкристаллы, сопротивление которых сильно изменяется в магнитном поле, могут найти практическое применение для записи информации. Наибольший интерес сейчас вызывают материалы на основе LaMnO4, в котором сверхкристаллы существуют при комнатной температуре. Уникальным свойством кристалла YBa2Cu3O7 является образование сверхпроводящих капель, что делает данный материал перспективным для использования в различных специфических фоточувствительных устройствах.
3.3. Ферриты
Феррит-шпинели не являются единственным типом ферритов. Ферритами называют любые ферромагнитные полупроводники и диэлектрики на основе оксидов железа и других металллов. С точки зрения структуры ферриты – ионные соединения, в которых анионы кислорода образуют плотную кубическую или гексагональную решетку, а катионы располагаются в пустотах, размеры которых – от 0,4 до 0,8 Å.
Ферриты широко используются в электротехнике, электронике, радиотехнике. Применение ферритов позволило решить ряд вопросов при создании современной вычислительной и сверхвысокочастотной техники, устройств связи, электронного приборостроения. Новая область применения материалов данного класса – создание эластичных магнитных материалов на основе полимерных композитов. Потери на вихревые токи (особенно на высоких частотах) значительно меньше у ферритов, которые имеют высокое сопротивление в сочетании с большой магнитной проницаемостью и удельной намагниченностью насыщения.
Классификация ферритов.
1. Феррит-шпинели. Наиболее широко применяемые ферриты – NiO-ZnO-Fe2O3, MnO-ZnO-Fe2O3, Ni-Co-ферриты.
2. Феррогранаты. Минерал гранат имеет формулу Са3Al2(SiO4)3, феррит-гранат M3Fe2(FeO4)3. M – катионы Y или лантаноидов. Феррит-гранаты имеют кубическую объемно центрированную решетку и отличаются наиболее высоким электрическим сопротивлением, низкими магнитными потерями, широким интервалом намагниченности насыщения. Это позволяет использовать их в устройствах сверхвысокочастотной техники.
3. Магнетоплюмбит – гексагональные ферриты состава BaFe12O19, в общем виде – nBaO·2MO·mFe2O3. В гексагональных ферритах решетка образуется ионами кислорода и бария, имеющими примерно равные радиусы. Ионы железа и M размещаются в пустотах. Этот тип ферритов отличается большими внутренними магнитными полями (полями анизотропии). Они имеют значения магнитной энергии, близкой к лучшим металлическим магнитам (наиболее сильные магниты на основе сплавов самария с кобальтом имеют магнитную энергию 200–250 кДж/м3; в настоящее время синтезируются еще более мощные магнитные материалы на основе неодима, железа и бора).
4. Ортоферриты с орторомбической структурой типа перовскита CaTiO3-MFeО3. M – Y, Gd, Eu, Er, Sm, Nd, La, Ce и др.
Ферриты всех типов синтезируются по керамической технологии (из оксидов) термическим разложением растворов солей, соосаждением гидроксидов, получением твердых растворов изоморфных солей. Возможен низкотемпературный синтез с использованием процессов типа молекулярного наслаивания.
Ферритобразующие системы. Характерным примером систем данного типа является NiO-ZnO-Fe2o3.
Ф

Рис. 3.2 - Диаграмма состояния системы NiO-Fe2O3
Тпл NiFe2O4 на воздухе – 1640 °С, в атмосфере кислорода – 1740 °С. Однако уже при 1300 °С давление кислорода над шпинелью рО2 = 1 атм. Тпл ZnFe2O4 вообще нельзя определить, поскольку Zn испаряется по реакции
ZnFe2O4 = Zn0 + Fe2O3 + 0,5O2.
Это затрудняет построение тройных диаграмм состояния системы, и они не являются равновесными.
В зависимости от режима охлаждения получают различные области образования твердых растворов шпинелей состава NixZn(1–x)Fe2O4. Магнитные свойства поэтому также зависят от режима спекания оксидов и охлаждения, причем изменение магнитных свойств наблюдается значительно раньше, чем изменение состава и структуры. В этой системе образуется много неферримагнитных оксидов и твердых растворов, что снижает характеристики ZnO, NiO, -Fe2O3.
Система ZnO-MnO-Fe2O3. На фазовой диаграмме системы Fe2O3-Mn2O3 при Т ниже 1000 °С фаза шпинели отсутствует. Шпинель может быть получена только закалкой от более высоких температур, причем режим охлаждения будет определять фазовый состав, структуру и магнитную проницаемость феррита (рис. 3.3). Возможность реакции между Mn2+ и Fe3+, а также изменение давления кислорода оказывают влияние на структуру, магнитные характеристики и электронную проводимость. Для получения ферритов высокого качества (с высокой магнитной проницаемостью, намагниченностью насыщения и низкой электропроводностью) необходима стабилизация pO2 .

Рис. 3.3. Диаграмма состояния системы MnO-Fe2O3
Это относится и к тройной системе MnO-Fe2O3-ZnO. Тетрагональные искажения кубической решетки шпинели при высоких содержаниях MnO указывают на присутствие гаусманита (Mn2O3) и связаны с отсутствием контроля за давлением кислорода при построении изотермических сечений. Результаты оценки этих искажений неоднозначны при использовании различных физических методов. Электронная микроскопия, в частности, оказывается более чувствительной, чем рентгеноструктурный анализ. Получение стехиометрической шпинели даже при малых pO2 невозможно, как видно из рис. 3.3 и 3.4. (Отклонения от стехиометрии, вероятно, связаны с энтропией смешения.)

Рис. 3.4. Зависимость начальной магнитной проницаемости
в системе MnO-Fe2O3-ZnO от состава. Охлаждение в вакууме в течение 5 мин
Даже при отсутствии искажений решетки магнитная проницаемость сильно зависит от режима охлаждения. Поэтому максимум характеристик наблюдается не при стехиометрических составах шпинели (например, Mn1–xZnxFe2O4). Для получения ферритов высокого качества (с высокой магнитной проницаемостью, намагниченностью насыщения и низкой электропроводностью) необходима стабилизация давления кислорода (рис. 3.5).
Термодинамическое описание синтеза феррит-шпинелей. Форма и ориентирование кристаллической структуры продуктов гетерогенных реакций зависит от структуры исходных фаз. Это явление, обнаруженное Хюттингом, связано с тем, что форма и ориентировка зародышей при кристаллизации в анизотропной среде соответствуют минимуму свободной энергии, который обеспечивается максимальным сходством в расположении атомов на соприкасающихся поверхностях реагентов и продуктов реакции. Поэтому ориентированная кристаллизация происходит при условии, что разность энергии образования двухмерного зародыша G2M и энергии адгезии Gad меньше или равна энергии образования трехмерного зародыша G3M при неориентированной кристаллизации, т. е.
G2M – Gad G3M.
