
- •130400 «Горное дело»
- •Введение
- •Химические и термохимические процессы при взрыве.
- •Вв как химическая система.
- •Явление взрыва.
- •Теплотворная способность горючих веществ
- •Объемная плотность энергий
- •Основные виды превращения взрывчатых систем.
- •Теплота взрывчатого превращения.
- •1.3 Экспресс - метод написания реакций взрывчатого превращения для расчета теплоты взрыва.
- •Кислородный баланс некоторых взрывчатых веществ и компонентов взрывчатых смесей.
- •Пример расчета кислородного баланса и написания реакций взрывчатого превращения.
- •Метод расчета теплоты взрыва без написания реакции взрывчатого превращения (метод Авакяна).
- •Пример расчета теплоты взрыва по методу Авакяна.
- •Расчет состава продуктов взрыва.
- •Основные взрывчатые характеристики
- •Объем газообразных продуктов взрыва
- •Температура взрыва
- •Значения коэффициентов a и b для расчета средней теплоемкости.
- •Давление продуктов взрывчатого превращения
- •Теоретический расчет продуктов взрывчатого превращения
- •Теоретический расчет продуктов взрывчатого превращения (первая группа вв )
- •Вторая группа вв ( )
- •Третья группа вв
- •3. Основные типы промышленных взрывчатых веществ.
- •3.1 Краткая история развития промышленных взрывчатых веществ.
- •Классификация взрывчатых веществ.
- •3.3 Современные промышленные вв
Теоретический расчет продуктов взрывчатого превращения
Химическая термодинамика дает возможность теоретически вычислять с большим приближением основной состав продуктов взрыва при заданных условиях, а также его изменения в процессе охлаждения.
На течение химических реакций оказывает влияние сила химического сродства между реагирующими веществами и количества их, влияние этих двух факторов учитывается законом действующих масс. Математическим следствием из него является так называемое уравнение химической изотермы, согласно которому для обратимой реакции.
![]() (71)
(71)
При наступлении равновесия имеет место следующие соотношения:
![]()
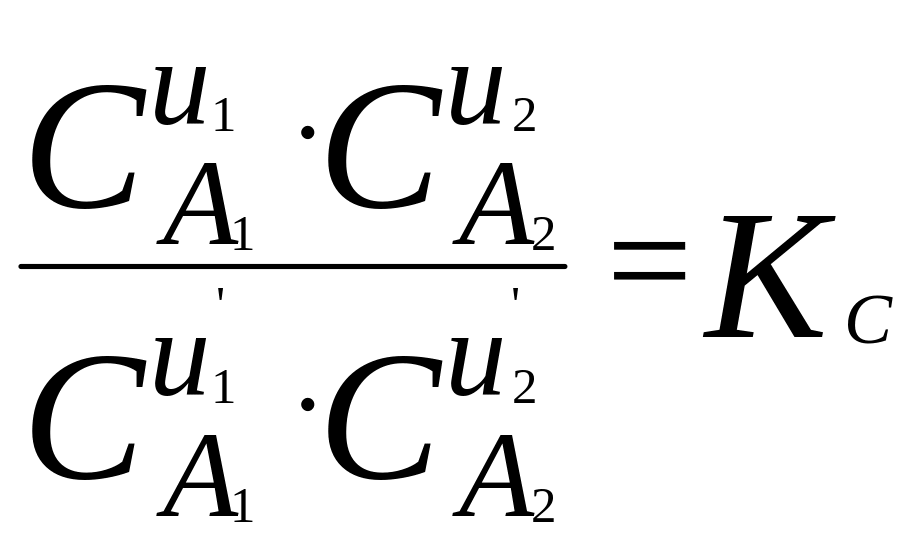 и
и 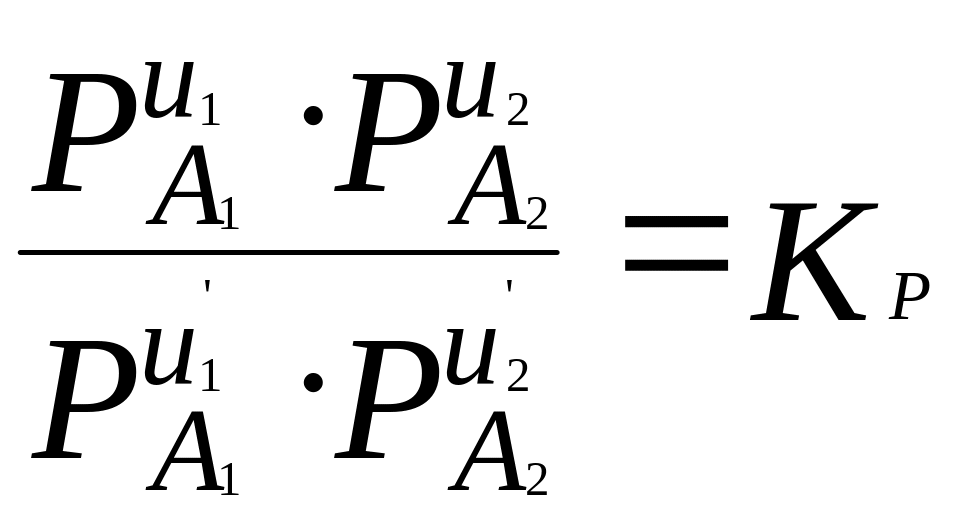 (72)
(72)
Здесь С – концентрация регулирующих веществ, Р – их парциальное давление.
Величины
![]() и
и
![]() имеют для каждой химической реакции
совершенно определённые значения,
зависящие только от температуры и
называются константами равновесия.
имеют для каждой химической реакции
совершенно определённые значения,
зависящие только от температуры и
называются константами равновесия.
Согласно предложению Эйкена, реакции следует писать так, чтобы положительный тепловой эффект был справа, выражения где для констант равновесия составляют так, чтобы в числителе были концентрации исходных веществ, а в знаменателе – концентрации полученных.
Например:
![]() Ккал (73)
Ккал (73)
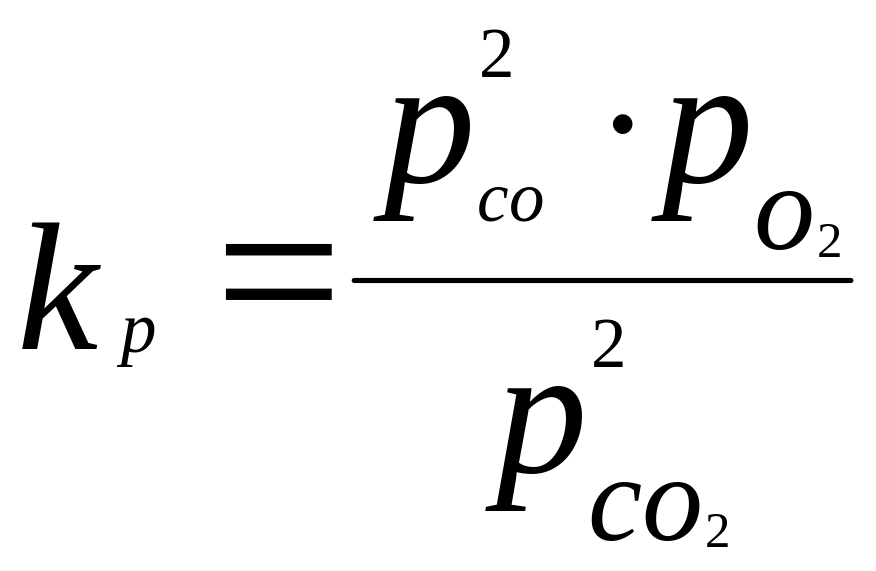 (74)
(74)
Теоретический расчет продуктов взрывчатого превращения (первая группа вв )
В продуктах взрыва содержится: продукт полного сгорания (СО2 и Н2О), продукты их диссоциации (СО, Н2, О2). Поэтому пренебрегая весьма незначительной диссоциацией Н2О, состав продуктов взрыва может быть выражен следующим уравнением:
![]()
Для нахождения неизвестных могут быть составлены следующие уравнения:

Кроме того, т.к. соотношения между СО, СО2 и О2 определяются равновесием
![]() ,
,
а соотношения между NO, N2 и O2 равновесием
![]() ,
,
то для определения неизвестных могут быть использованы ещё следующие уравнения:
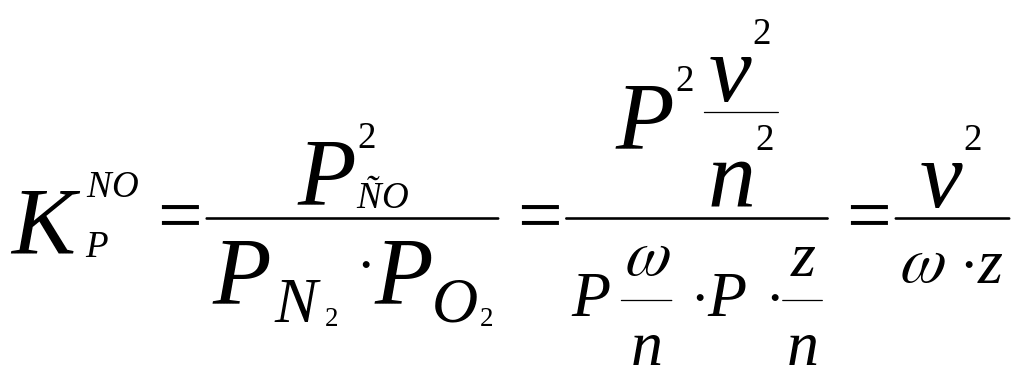

где P – общее давление и n – сумма всех газообразных молей.
Но
![]() поэтому
поэтому
![]() можно заменить через
можно заменить через
![]() ,
где V
– объём, в котором происходит взрыв
молекулы ВВ, т.е. величина, заданная
условиями взрыва.
,
где V
– объём, в котором происходит взрыв
молекулы ВВ, т.е. величина, заданная
условиями взрыва.
Таким образом, для решения имеется следующая система уравнений:
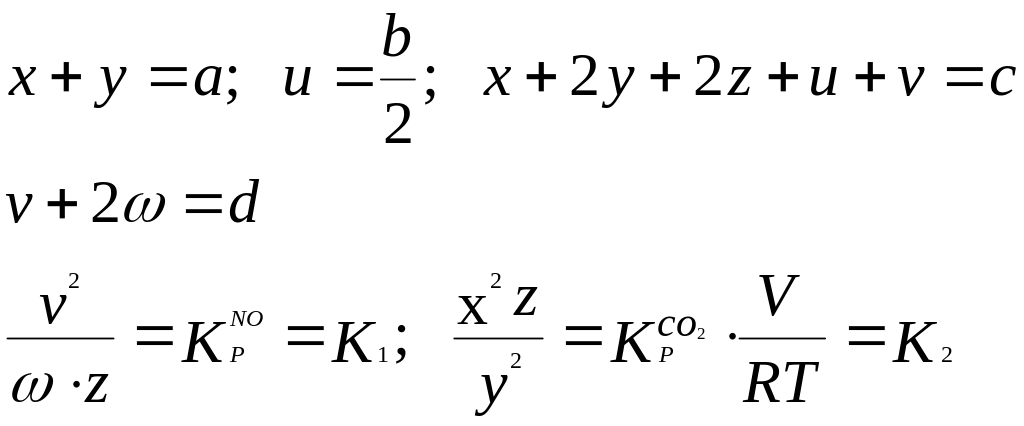
Отсюда зная
температуру Т и соответствующие ей
величины констант
![]() и
и
![]() ,
можно определить все неизвестные. Однако
решение этой системы довольно сложное,
т.к. оно сводится к решению уравнения
четвёртой степени общего вида:
,
можно определить все неизвестные. Однако
решение этой системы довольно сложное,
т.к. оно сводится к решению уравнения
четвёртой степени общего вида:
![]()
Если же пренебречь образованием окислов азота, то решение задачи значительно упростится, а именно,
Тогда
![]() отсюда:
отсюда:

а эта система приводится к уравнению только третьей степени.
Правда при таком упрощении задачи, когда она ограничена определением степени диссоциации СО2, можно прямо воспользоваться экспериментальными данными о степени диссоциации углекислого газа в зависимости от температуры и давления. Для этого руководствуясь правилом наибольшего выделения тепла нужно составить ориентировочное уравнение реакции взрывчатого превращения, задаться ожидаемой температурой взрыва Т, на внешней её заданной мощности заряжания определять парциальное давление СО2.
После этого нужно проверить правильность измерений температуры и в случае необходимости произвести снова вычисления парциального давления и степени диссоциации СО2.
Пример:
Пусть в качестве ВВ дан Гремучий студень, 1кг которого имеет элементный состав:
![]()
Ориентировочный состав продуктов взрыва его будет:
14,1СО2 + 11,4Н2О + 6,4N2
Зададимся
температурой взрыва Т=4000°К. Пусть
плотность заряда
![]() .
Тогда в предположении, что детонация
происходит в объёме заряда и что в момент
её справедливо уравнение идеальных
газов, парциальное давление СО2
будет равно:
.
Тогда в предположении, что детонация
происходит в объёме заряда и что в момент
её справедливо уравнение идеальных
газов, парциальное давление СО2
будет равно:
![]()
При этих давлениях
степень диссоциации углекислого газа
![]() %.
%.
И таким образом состав продуктов детонации будет:
11,3 СО2 + 2,8 СО + 1,4 О2 + 11,4 Н2О + 6,4N2
Вычисляем теперь температуру взрыва для написанного уравнения:
Теплота образования:
11,3 СО2 ------ 11,3*94,3 = 1066 ккал
2,8 СО ------ 2,8*26,2 = 73 ккал
11,4 Н2О ------ 11,4*57,8 = 659 ккал
-------------------------------------------------
1798 ккал
Теплота образования
гремучего студня ------ 437 ккал
Взрывчатого превращения ------ 1361 ккал
Поправка на работу расширения ----- 0,57*33,3 = 19 ккал
Теплота взрывчатого превращения ----- 1380 ккал
Теплоемкость продуктов взрыва:
для 2-х атомных газов ---- (4,8 + 0,00045t)*10,6 = 50,9 + 0,00477 t
11,3 СО ---- (4,0 + 0,00058 t)*11,3 = 101,7 + 0,00656 t
11,4 Н2О ---- (4,0 + 0,00215 t)*11,4 = 45,6 + 0,0245 t
-------------------------------------------------------------------------------
198,2 + 0,03583 t
а = 198,2
b = 0,03583
Отсюда Твзр равная:
![]()
Или 4290°К.
