
- •Указания к лабораторной работе №1
- •Опыт № 2. Приготовление растворов заданной концентрации.
- •7. Контроль:
- •Указания к лабораторной работе №2
- •7. Контроль:
- •Указания к лабораторной работе №3
- •7. Контроль:
- •Опыт №2 . Влияние разбавления на рН буферного раствора
- •7. Контроль:
- •Указания к лабораторной работе 5
- •Опыт 6. Получение анионного комплексного соединения Zn3[Fe(cn)6]2
- •Опыт 7. Получение катионного комплексного соединения [Сu(nh3)4]so4
- •Опыт 8. Электролитическая диссоциация комплексного соединения к3[Fe(cn)6].
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •Решение задач и упражнений
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
- •7. Контроль:
7. Контроль:
№1. Среди перечисленных веществ, укажите поверхностно-активные вещества: хлорид натрия, масляная кислота, пентанол–1, глюкоза, холестерин, стеарат натрия.
№2. Расположите в порядке увеличения адсорбционной способности в поверхностном слое следующие нормальные спирты: гексанол, этанол, метанол, октанол, додеканол–1 (С12Н25ОН или лауриновый спирт).
№3. Расположите в порядке увеличения адсорбционный способности на каолине ионы: Nа+ , Сr3+, Ni2+.
№4. Укажите среди перечисленных веществ дифильные молекулы: уксусная кислота, олеат натрия, хлорид кальция, стеариновая кислота, глюкоза.
№5. Пользуясь правилом Траубе–Дюкло, вычислить во сколько раз поверхностная активность масляной кислоты С3Н7СООН больше поверхностной активности уксусной кислоты СН3СООН. (Ответ 10 раз.)
Указания к лабораторной работе №8
Тема: Особенности растворов ВМС.
Опыт 1. Обратимое осаждение белков нейтральными солями (высаливание). Опыт демонстрационный.
В стаканчик наливают 8-10 мл раствора яичного белка и прибавляют небольшими порциями порошок сернокислого аммония до насыщения. Для ускорения растворения содержимое взбалтывают. Наблюдают осаждение белка в виде белых хлопьев. Часть содержимого стаканчика переносят в пробирку и прибавляют воду. Отмечают растворение осадка белка, происходящее вследствие уменьшения концентрации соли в растворе.
Опыт 2. Осаждение белков спиртом. Опыт демонстрационный.
В пробирку наливают 1-2 мл раствора яичного белка и около 1 мл этилового спирта. Наблюдают появление белой мути а затем осадка. Часть содержимого пробирки переносят в другую пробирку и добавляют в нее 3-4 мл воды. Происходит растворение осадка наблюдается в том случае, когда спирт и раствор белка предварительно охлаждены до 00.
Сущность реакции. Под действием спирта, обладающего гидрофильными свойствами, частицы белка теряют гидратную оболочку и выделяются из раствора. Осаждение является обратимым, и при уменьшении концентрации спирта (разбавленной водой) белок снова переходит в растворенное состояние. При длительном контакте со спиртом происходит денатурация белка и осаждение становится необратимым.
Опыт 3. Осаждение белка при действии высокой температуры.
В пробирку наливают 1-2 мл раствора яичного белка и содержимое пробирки нагревают до кипения. Отмечают образование белого осадка. Белок при этом денатурируется и осаждение является необратимым.
7. Контроль:
Задачи и упражнения:
№1. Изоэлектрическая точка белка пепсина находится при рН =2. Укажите, при каком из предложенных значений рН степень набухания и скорость желатинирования будет: а) максимальной, б) минимальной?
рН1 = 1,8; рН2= 2,0; рН3 = 5,0; рН= 3,0
№2. Белок казеин молока имеет изоэлектрическую точку при рН = 4,6. Укажите, при каком значении рН скорость осаждения и скорость электрофореза этого белка будет: а) максимальной, б) минимальной?
1) рН = 4,6 2) рН= 1,0 3) рН= 5,0 4) рН= 4,2
№3. Какие изменения в свойствах и структуре белков происходят при денатурации?
№4. Назовите высокомолекулярные вещества организма человека. Из каких мономеров они образованы?
№5. Изменение, каких параметров увеличивает скорость застудневания ВМС?
№6. Действие, каких факторов уменьшает степень коагуляции ВМС?
№7. Почему растворы некоторых ВМС обладают аномально высокой вязкостью?
№8. Какое давление называют «онкотическое давление»?
Указания к лабораторной работе №9
Тема: Кислотность основность органических соединений
Опыт №1. Получение глицерата меди.
В две пробирки наливают по 10-12 капель 10% раствора гидроксида натрия NaOH и по 2-3 капли 5% раствора сульфата меди (II) CuSO4. После этого к содержимому первой пробирки прибавляют 3-4 капли глицерина (до растворения осадка), а ко второй пробирке - 3-4 капли этанола, встряхивают. В первой пробирке происходит растворение осадка с образованием глицерата меди синего цвета (см. уравнение реакций)
2 NaOH + CuSO4 Cu(OH)2 + Na2SO4
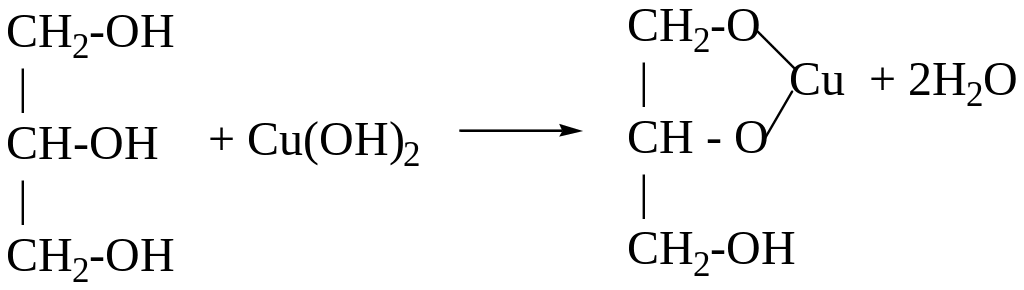
Глицерат меди
Объясните причину происходящего.
Сделайте вывод о различии кислотных свойств глицерина и этанола.
Опыт №2. Доказательство кислых свойств фенолов – получение фенолята натрия и изучение его свойств.
В пробирку помещают 5-6 капель раствора фенола в воде и по каплям добавляют 10% раствор гидроксида натрия NaOH до растворения фенола. Образуется растворимый в воде фенолят натрия.
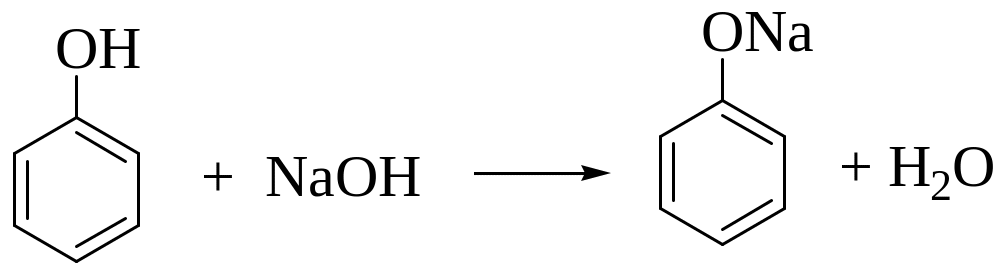
Фенолят натрия
К полученному раствору фенолята натрия прибавляют по каплям 5% раствор уксусной кислоты СН3СООН до появления мути вследствие образования свободного фенола:
С6Н5-ОNa + СН3СООН С6Н5-ОН + СН3СООNa
Объясните наблюдаемые явления.
Сделайте вывод о феноле как ОН-кислоте.
