
- •Вопрос 1. Метод и законы Термодинамики. Основные понятия и определения. Термодинамика - наука, изучающая законы превращения энергии и особенности процессов этих превращений. Три начала термодинамики:
- •Вопрос 2. Параметры состояния и уравнения состояния.
- •Вопрос 3. Термодинамическая работа, координаты p-V.
- •Вопрос 4. Потенциальная работа, координаты p-V, распределение работы.
- •В случае если , то .
- •В случае если дано уравнение процесса - , то .
- •Вопрос 5. Истинная и средняя теплоёмкости веществ.
- •Вопрос 6. Смеси жидкостей, паров и газов, расчёт характеристик смеси веществ.
- •Вопрос 8. Определение температуры смеси. Теплоёмкость смеси.
- •Вопрос 9. Термодинамические условия фазовых переходов
- •Вопрос 10. Критические параметры чистого вещества и смеси газов.
- •Вопрос 11. Теория соответственных состояний. Коэффициент сжимаемости
- •Вопрос 12. Постулат и математическое выражение первого начала термодинамики.
- •Вопрос 13. Первое начало термодинамики в аналитической форме.
- •Вопрос 14. Первое начало термодинамики для идеального газа.
- •Вопрос 15. Принцип существования энтропии идеального газа.
- •Вопрос 16. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах p-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •17. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах “t-s”,связь между параметрами, работа и теплообмен, изменение функций состояния.
- •18. Изохорный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах “р-V”,связь между параметрами, работа и теплообмен, изменение функций состояния.
- •19. Изохорный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах “t-s”,связь между параметрами, работа и теплообмен, изменение функций состояния.
- •20. Изопотенциальный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах “p-V”,связь между параметрами, работа и теплообмен, изменение функций состояния.
- •Вопрос 27.Политропа простого тела
- •Вопрос 28.Политропный процесс,работа и теплообмен
- •Вопрос 29.Политропа ид.Газа,изображение в t-s
- •30.Политропный процесс идеального тела
- •Вопрос 31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности.
- •Вопрос 32. Дифференциальное уравнение теплопроводности. Условия однозначности. Условности:
- •Вопрос 39. Теплообмен излучением. Основные законы.
- •Вопрос 40. Теплообмен излучением между телами.
- •Вопрос 43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •Вопрос 44. Теплопередача через плоские однослойные и многослойные стенки.
- •Вопрос 45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •Вопрос 51. Обобщенные уравнения теплопередачи при переменных температурах.
- •Вопрос 56. Математическое выражение второго начала термостатики. Основные следствия.
- •Вопрос 57. Математическое выражение второго начала термодинамики. Основные следствия.
- •Вопрос 58. Истечение жидкостей и газов. Основные расчетные соотношения. Истечение несжимаемой жидкости.
- •Вопрос 59(60). Особенности истечения сжимаемой жидкости.
- •Вопрос 61. Переход через критическую скорость, сопло Лаваля, определение геометрических размеров.
- •Вопрос 62. Особенности истечения через каналы переменного сечения, сопло и диффузор. Уравнение истечения: .
- •Вопрос 63. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •Вопрос 64. Процесс парообразования. Определение параметров влажного или насыщенного пара. Диаграмма h-s
- •Вопрос 68. Сопоставление термодинамических циклов Брайтона и Гэмфри по эффективности.
- •Вопрос 69. Схема, рабочий процесс и термодинамический цикл Отто, кпд.
- •Вопрос 70. Схема, рабочий процесс и термодинамический цикл Дизеля, кпд.
- •Вопрос 72. Сопоставление термодинамических циклов двс по эффективности.
- •Вопрос 76. Схема, рабочий процесс, и цикл воздушной холодильной машины
- •77.Рабочий цикл четырёхтактного дизеля
- •78.Двухтактный дизель
- •80. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
Вопрос 1. Метод и законы Термодинамики. Основные понятия и определения. Термодинамика - наука, изучающая законы превращения энергии и особенности процессов этих превращений. Три начала термодинамики:
1-ое Начало Термодинамики характеризует собой количественное выражение закона сохранения и превращения энергии: «энергия изолированной системы при всех изменениях, происходящих в системе, сохраняет постоянную величину». 2-ое Начало Термодинамики характеризует качественную сторону и направленность процессов, происходящих в системе. Важнейшим следствием второго начала является утверждение о невозможности осуществления полных превращений теплоты в работу. 3-е Начало Термодинамики (закон Нерста) гласит о том, что при абсолютном нуле температур все равновесные процессы происходят без изменения энтропии.
Метод термодинамики заключается в строгом математическом развитии исходных постулатов и основных законов, полученных на основе обобщения общечеловеческого опыта познания природы и допускающих прямую проверку этих положений во всех областях знаний.
Система–тело или совокупность тел, находящихся в механическом и тепловом взаимодействии. Системы делятся на закрытые и открытые системы. Закрытая система–система, в которой количество вещества остаётся постоянным при всех происходящих в ней изменениях. Закрытые системы делятся на изолированные и неизолированные системы. Изолированная система – система, у которой нет энергетического взаимодействия с внешней средой. Гомогенная - система, состоящая из одной фазы вещества или веществ. Однородная - гомогенная система, неподверженная действию гравитационных, электромагнитных и других сил и имеющая во всех своих частях одинаковые свойства. Гетерогенная - система, состоящая из нескольких гомогенных частей (фаз), отделенных поверхностью раздела. Равновесное состояние системы - состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия. Термодинамическая система – система, внутреннее состояние которой может быть описано независимыми переменными, которые называются параметрами состояния. Простое тело – тело, у которого два параметра состояния. Идеальный газ – тело, у которого один параметр состояния. __________________________________________________________
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния - физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1.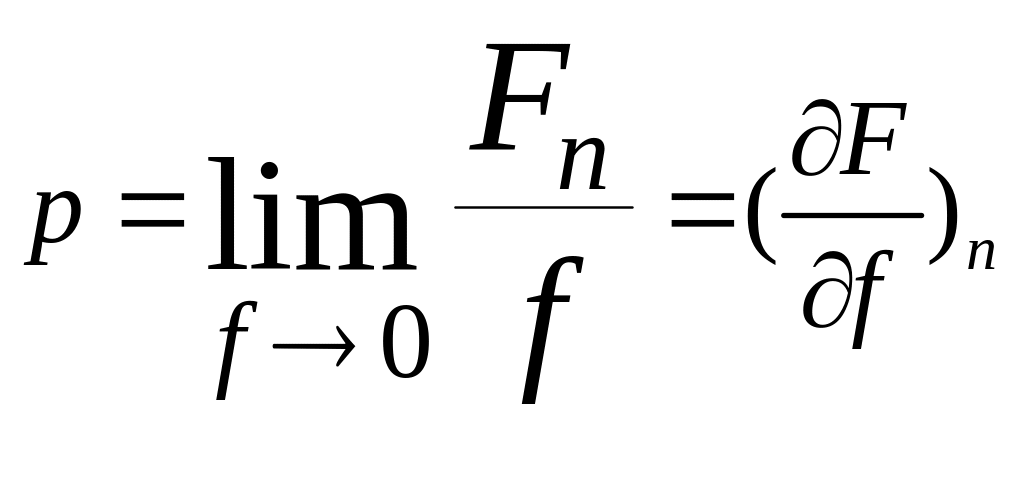 - абсолютное
давление -
численно равно силе F,
действующей на единицу площади f
поверхности тела ┴
к последней, [Па=Н/м2]
- абсолютное
давление -
численно равно силе F,
действующей на единицу площади f
поверхности тела ┴
к последней, [Па=Н/м2]
2.![]() - удельный
объём-это
объем единицы массы вещества.
- удельный
объём-это
объем единицы массы вещества.
3.
![]() Температура
есть
единственная функция состояния
термодинамической системы, определяющая
направление самопроизвольного теплообмена
между телами.
4.
Температура
есть
единственная функция состояния
термодинамической системы, определяющая
направление самопроизвольного теплообмена
между телами.
4. Плотностью
вещества
принято называть отношение массы тела
к его объему
Плотностью
вещества
принято называть отношение массы тела
к его объему
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс - это непрерывная последовательность равновесных состояний системы.
Обратимый процесс - равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессом принято считать обратимый равновесный процесс.
Равновесные
процессы могут
быть
изображены графически на диаграммах
состояния p-v,
р-Т
и т. д. Линия, изображающая изменение
параметров в процессе, называется кривой
процесса.
Каждая точка кривой процесса характеризует
равновесное состояние системы.
Уравнение
термодинамического процесса
– уравнение вида
![]() .
.
Уравнение
состояния
для простого тела -
![]() .
Идеальный
газ
– совокупность материальных точек
(молекул или атомов), находящихся в
хаотическом движении. Эти точки
рассматриваются как абсолютно упругие
тела, не имеющие объёма и не взаимодействующие
друг с другом. Уравнением
состояния идеального газа
является уравнение Менделеева-Клапейрона:
PV=nRT,
где P
– давление, [Па]; V
– объём системы [м3];
n
– количество вещества, [моль]; T
– термодинамическая температура, [К];
R
– универсальная газовая постоянная.
Реальный
газ
– газ, молекулы которого взаимодействуют
друг с другом и занимают определённый
объём. Уравнением
состояния реального газа
является обобщённое уравнение
Менделеева-Клапейрона:
.
Идеальный
газ
– совокупность материальных точек
(молекул или атомов), находящихся в
хаотическом движении. Эти точки
рассматриваются как абсолютно упругие
тела, не имеющие объёма и не взаимодействующие
друг с другом. Уравнением
состояния идеального газа
является уравнение Менделеева-Клапейрона:
PV=nRT,
где P
– давление, [Па]; V
– объём системы [м3];
n
– количество вещества, [моль]; T
– термодинамическая температура, [К];
R
– универсальная газовая постоянная.
Реальный
газ
– газ, молекулы которого взаимодействуют
друг с другом и занимают определённый
объём. Уравнением
состояния реального газа
является обобщённое уравнение
Менделеева-Клапейрона:
![]() ,
где Zr
=
Zr(p,T)
– коэффициент сжимаемости газа; m
– масса; M
– молярная
масса.
_____________________________________________________________
,
где Zr
=
Zr(p,T)
– коэффициент сжимаемости газа; m
– масса; M
– молярная
масса.
_____________________________________________________________
