
- •Москва 2016 содержание
- •Термодинамика полимеризации
- •Ионная полимеризация. Общие закономерности ионной полимеризациии
- •Катионная полимеризация
- •Основные характеристики катионной полимеризации:
- •Инициирование катионной полимеризации
- •Образование иона карбония
- •Сродство к протону
- •Изменение свободной энергии при образовании иона карбония
- •Энергия сольватации
- •Энергия реакции инициирования галогенсодержащими кислотами
- •Теплота реакции катионов с олефинами
- •Анионная полимеризация
- •Инициирование
- •Рост цепи
- •Ионные пары и свободные ионы
- •Список использованной литературы
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
Российский химико-технологический университет
им. Д. И. Менделеева
ДОКЛАД
по учебной дисциплине: «»
на тему: «»
Выполнил: магистрант 1 курса группы МП-11
Хавпачев М.А.
Проверил: д. х. н., проф. зав. каф. химической
технологии пластических масс Киреев В.В.
Москва 2016 содержание
ВВЕДЕНИЕ
1Термодинамика полимеризации……………………………………………………
2 Ионная полимеризация……………………………………………………………..
2.1 Общие закономерности ионной полимеризациии………………………………..
2.2 Катионная полимеризация………………………………………………………….
2.2.1 Образование иона карбония……………………………………………….
2.2.2 Сродство к протону……………………………………………………………
2.2.3 Изменение свободной энергии при образовании иона карбония…………
2.2.4 Энергия сольватации……………………………………………………..
2.2.5 Энергия реакции инициирования галогенсодержащими кислотами….
2.2.6 Теплота реакции катионов с олефинами………………………………….
2.3 Анионная полимеризация……………………………………………………
2.3.1 Ионные пары и свободные ионы………………………………………….
ЗАКЛЮЧЕНИЕ………………………………………………………………………
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ……………………………………
Термодинамика полимеризации
Основным термодинамическим условием протекания реакции полимеризации, как и любого другого химического процесса, является убыль свободной энергии Гиббса или изобарно-изотермического потенциала:

где ΔG – изменение свободной энергии Гиббса или изобарно-изотермического потенциала;
ΔH – изменение энтальпии системы, равное суммарному тепловому эффекту процесса с обратным знаком;
ΔS – изменение энтропии системы.
Если полимер имеет более низкую свободную энергию, чем соответствующий мономер, то полимеризация может протекать самопроизвольно, и ΔG отрицательно. Положительное ΔG означает, что полимеризация не может протекать самопроизвольно. Если система находится в равновесии при определенной критической температуре и полимеризация не происходит, что ΔG=0.
Три перечисленных выше случая изменения свободной энергии при полимеризации могут быть записаны в следующей форме:

Из уравнения (1), определяющего термодинамическую возможность протекания полимеризации, следует, что при повышении температуры может быть достигнуто равенство энтальпийного и энтропийного членов ΔН=ТΔS, ΔG станет равным нулю и процесс прекратится. Дальнейший рост температуры способствует повышению свободной энергии (ΔG>0) и вызывает обратный процесс образования мономера из полимера – деполимеризацию. Следовательно, процесс полимеризации является равновесным, а температура, при которой скорости прямого и обратного процессов сравняются, называется предельной – Тпр. Поскольку при равновесии ΔG=ΔH –TΔS=0, то предельная температура равна:
![]()
где ΔНр и ΔSр – изменение энтальпии и энтропии в расчете на мономерное звено
Для
больших степеней полимеризации эти
величины называются энтальпией и
энтропией полимеризации. Если за
стандартное состояние принята единичная
концентрация мономера и раствор является
идеальным, то ΔS=ΔS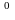 +Rln[M]
и:
+Rln[M]
и:

ΔS -энтропия полимеризации в стандартном состоянии при единичной концентрации мономера. Поэтому Тпр можно повысить, увеличивая концентрацию мономера при полимеризации в растворе.
Из уравнения (4) следует, что Тпр характеристической величиной для равновесия мономер-полимер, не зависящей от природы активных центров в системе. Для данного значения концентрации мономера предельная температура будет одинаковой для активных центров радикального и ионного типа.
Многие полимеры вполне стабильны выше их предельной температуры, так как образование активных центров при деструкции полимерных молекул затруднено. Подобное состояние является метастабильным равновесием. Таким образом, полимер не может деполимеризоваться самопроизвольно, но будет разлагаться при определенных условиях. Остатки катализатора, не удаленные в процессе очистки полимера, также могут вызывать деполимеризацию.
Можно выделить четыре области условий протекания полимеризации:
1. Если ΔН и ΔS отрицательны, то ΔG становится положительной величиной выше Тпр системы, и высокомолекулярный полимер не может быть получен выше Тпр.
2. Если полимеризация эндотермична (ΔН>0) и ΔS больше нуля, то полимер не может существовать ниже предельной температуры, выше которой ΔG становится отрицательной.
3. Если ΔН – положительная величина, а ΔS – отрицательная, ΔG всегда положительно, поэтому полимер не может существовать ни при какой температуре.
4. Если ΔН – отрицательная величина, а ΔS – положительная, то ΔG всегда отрицательно, поэтому полимер может существовать при любой температуре.
