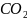- •Иваново 2015 содержание:
- •Основная часть
- •Строение карбоксильной группы:
- •Изомеры Фталевого ангидрида:
- •2. Запишите термодинамическое уравнение реакции образования вещества из простых веществ.
- •3. Рассчитайте , реакции полного сгорания вещества в атмосфере кислорода. Определите, какое количество моль вещества, выделится при сгорании 300 кг.
- •4.Запишите уравнения реакции горения вещества в атмосфере воздуха и кислорода. Рассчитайте количество моль вещества, вступившего в реакцию сгорания.
- •5.Определите горючесть вещества.
- •6.Используя закон кратных отношений, вычислите состав вещества в массовых долях.
- •8. Определите степени окисления атомов, входящих в состав молекулы вещества.
- •9.Определите окислитель и восстановитель в реакции сгорания вещества в атмосфере кислорода. Определите стехиометрические коэффициенты методом электронного баланса.
- •12. Определите объем продуктов сгорания вещества в атмосфере воздуха и их процентное содержание.
- •13. Рассчитайте число молекул воды и углекислого газа, которое образуется в зоне горения при полном сгорании всей массы горючего вещества.
- •15.Опишите основные способы получения вещества и его химические свойства.
- •16. Приведите составы и способы тушения пожаров с участием указанного вещества.
- •Заключение
- •Список учебной литературы:
Изомеры Фталевого ангидрида:
1,5-Бензолкарбоновой кислоты
3,6- Парабензолкарбоновой кислоты
Вывод:
Проанализировав строение молекулы фталевого ангидрида я узнал: что фталевый ангидрид представляет собой бесцветные кристаллы, практически нерастворимые в воде, умеренно растворимые в органических растворителях.
Проявляет свойства ароматических соединений. Со спиртами при нагревании в присутствии серной кислоты образует сложные моно- и диэфиры, с многоатомными спиртами — полиэфиры (алкидные смолы). Фталевый ангидрид является исходным реагентом для получения различных производных фталевой кислоты: её сложных эфиров, фталимида, фталонитрила. Фталевый ангидрид является сырьём для производства глифталевых и пентафталевых красителей производных флуоресцеина, родамина и антрахинона, лекарственных средств. Фталевый ангидрид ядовит, раздражает кожу и слизистые оболочки глаз и носа, способствует заболеванию бронхиальной астмой.
2. Запишите термодинамическое уравнение реакции образования вещества из простых веществ.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента.
Фталевый ангидрид состоит из таких простых веществ как углерод, кислород, водород.
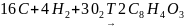
Вывод: данное термодинамическое уравнение из простых веществ возможно.
3. Рассчитайте , реакции полного сгорания вещества в атмосфере кислорода. Определите, какое количество моль вещества, выделится при сгорании 300 кг.
|
|
|
(Дж* |
С10Н8 Нафталин |
-29,79 |
130,70 |
360,56 |
Кислород |
0 |
0 |
205,138 |
Вода |
-285,83 |
-237,13 |
69,91 |
Оксид углерода |
-393,51 |
-394,36 |
213.74 |
Фталевый ангидрид |
-460,66 |
-330,96 |
179,49 |
Термодинамические свойства веществ. Таблица 1.


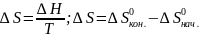







Ответ:
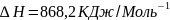
 Дано:
Решение:
Дано:
Решение:
q =22000 кДж/кг Q=q*m
 m=300
кг Q=
22000*300 = 66*
m=300
кг Q=
22000*300 = 66* кДж
кДж
Q - ?
Ответ: Q=66* кДж.
4.Запишите уравнения реакции горения вещества в атмосфере воздуха и кислорода. Рассчитайте количество моль вещества, вступившего в реакцию сгорания.
Горение — быстропротекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания.
Решение:

Кол-во вещества:
Для расчета количества моль 300 кг. фталевого ангидрида вступившего в реакцию горения используется формула :

Ответ:
Количество
молей вещества, вступившего в реакцию
 .
.
5.Определите горючесть вещества.
Решение:
Для определения горючести фталевого ангидрида требуется определить коэффициент горючести, он рассчитывается по формуле:
К =4n(C)+n(H)-2n(O)
где n-это число атомов углерода, водорода, кислорода.
В молекуле фталевого ангидрида :
n(C)=8, n(H)=4, n(O)=3;
Если
К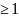 ,
то вещество является горючим.
,
то вещество является горючим.

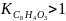 ,
следовательно вещество является горючим.
,
следовательно вещество является горючим.