
- •3.Принципы защиты от газовой коррозии.
- •4.Методы защиты от коррозии.
- •5. Структура химического предприятия. Классификация технологических процессов и оборудования.
- •2. Классификация процессов
- •3. Классификация и виды технологического оборудования
- •6.Легированные стали, применение в химическом машиностроении
- •8.Весовые дозаторы. Устройство, применение.
- •9.Весовые дозаторы периодического действия, устройство и применение.
- •10.Винтовые конвейера. Конструкция, применение, производительность.
- •11.Ленточные конвейера. Конструкция, расчет производительности.
- •14.Рабочие, расчетные, испытательные параметры. Аппараты, подведомственные Промтехнадзору, особенности их испытаний.
- •15.Трубопроводы, основные элементы, выбор труб.
- •16.Критерии прочности материалов, коэффициент запаса, влияние температуры.
- •2.2.1. Определение допускаемых напряжений
- •2.2.2 Прибавки к номинальным расчетным толщинам
- •17.Методы защиты от коррозии.
- •18.Принципы подбора оборудования.
- •19.Выбор материала и способы защиты от коррозии.
- •20.Аппараты объемного типа – расчет объема с учетом степени заполнения, времени пребывания и запаса производительности.
- •26.Прокладочные материалы.
- •27. Конические днища, применение.
- •27.Элеваторы, их устройство и применение.
- •28.Выбор материала и способы его защиты от коррозии.
- •30.Машины для перемещения и сжатия газов., типы, конструкция,областиприменения.
- •31.Установки пневмотранспорта, их виды, достоинства и недостатки, области применения.
- •32.Отстойники и фильтры для разделения жидкости и твердого материала.
- •33.Затворы для аппаратов высокого давления.
- •34.Эллиптические днища, области применения.
- •35.Металлы и сплавы для химического машиностроения.
- •36.Огнеупорные и теплоизоляционные материалы, применяемые в химической промышленности.
- •37.Плоские днища и крышки, области применения.
- •38.Насосы, конструкция, применение, выбор.
- •39.Вентиляторы центробежные, конструкции, применение, выбор.
- •40.Тарельчатый питатель, устройство применение.Н
- •41.Конденсаторы линейного расширения трубопроводов: сальниковый, линзовый и р-образный, конструкция, применение.
- •42.Задвижки, вентили и предохранительные клапаны: конструкция и применение.
- •43.Арматура трубопроводов: конструкция, области применения.
- •30Нж20бк – задвижка запорная (30), с корпусом из нержавеющей стали (нж), клиновая, фланцевая с выдвижным шпинделем без привода по каталогу 20, без вставок уплотнительных колец (бк).
- •44.Значение оборудования в производстве, его классификация.
- •2. Классификация процессов
- •3. Классификация и виды технологического оборудования
- •45.Барабанный (секторный) питатель. Конструкция, применение.
- •47.Критерии прочности, коэффициенты запаса прочности и условия их использования.
- •50.Трубопроводы. Принцип выбора труб. Расчет.
- •52.Поршневые (объемные) насосы, конструкция, области применения.
- •53.Органические коррозионно-устойчивые материалы.
- •54.Ленточный, (пластинчатый) питатель. Конструкция, применение.
- •55.Шнековый питатель, устройство, области применения.
- •56.Требования к оборудованию.
- •57.Затворы аппаратов высокого давления с упругой деформацией. Конструкция.
- •58.Влияние различных факторов на скорость коррозии (температуры, природы и концентрации реагентов, особенностей конструкции).
- •61.Бункеры и затворы для сыпучих материалов.
- •62.Затворы аппаратов высокого давления с пластичной деформацией. Конструкция.
- •63.Аппараты для разделения гетерогенных систем (газ – твердое).
- •64.Расчет колонных аппаратов на прочность и устойчивость.
- •65.Химическая коррозия.
- •66.Типовые конструкции гладких цилиндрических обечаек. Требования к их конструкции и изготовлению.
- •67.Расчет гладких цилиндрических обечаек на наружное давление.
- •68.Расчет гладких цилиндрических обечаек под действием осевой сжимающей силы, изгибающего момента и наружного давления.
- •1.Программно-целевая структура проектирования.
- •2.Методы проектирования, их характеристика и сравнение.
- •3.Генеральный план предприятия. Основные принципы и стадии его проектирования.
- •4.Генеральный план. Зональный принцип его формирования и характеристика отдельных зон.
- •5.Генеральный план. Характеристика объектов, включаемых в состав предприятия.
- •6.Предпроектные работы. Состав и содержание тэо.
- •8.Виды и структура проектных организаций.
- •9.Основные принципы проектирования промышленных зданий.
- •10.Понятие стандартизации и унификации. Унифицированные типовые секции и габаритные схемы.
- •11.Принцип выбора географического местоположения предприятия.
- •12.Принципы выбора этажности и высоты помещения.
- •13.Здания, этажерки и площадки для размещения оборудования.
- •2.2.2.2. Покрытия
- •2.2.2.7 Окна, двери, ворота
- •16.Фундаменты, виды фундаментов и их назначение
- •20.Способы компоновки оборудования, их характеристика.
- •21.Последовательность выполнения компоновки и общие принципы размещения технологического оборудования.
- •22.Характеристика помещений, включаемых в состав производства, и особенности их компоновки.
- •23,24.Характеристика открытого и закрытого варианта компоновки оборудования.
- •25.Сетка разбивочных осей, основные параметры промышленных зданий.
- •4 Указывают под полкой линии-выноски, либо на полке
- •28.Генеральный план предприятия. Основные принципы и стадии его проектирования
- •29.Основные принципы проектирования промышленных зданий.
- •30.Понятие проект. Характеристика методов проектирования
Физико-химические основы электрохимической коррозии, возникновение гальванопар.
Электрохимическая коррозия возникает при воздействии на металлы и сплавы (проводники I рода) электролитов (проводники II рода), т. е. растворов солей, кислот, щелочей, влажных газов и расплавов солей. Разрушение металла связано с прохождением электрического тока вследствие образования микро- и макрогальванических пар между участками металла с различным составом или различной активностью коррозионной среды (классическое определение).
То есть для возникновения электрохимической коррозии необходимы следующие условия:
1) неоднородный по составу металл или металл с различной активностью коррозионной среды на различных его участках;
2) наличие электролита на поверхности металла.
Разберемся, откуда вообще в данном случае возникает электрический ток и каким образом при этом происходит разрушение металла?
Для металлов характерна металлическая связь, т. е. в узлах кристаллической решетки расположены положительно заряженные ионы металла, а внутри решетки хаотично движутся электроны. Ионы удерживаются электростатическим притяжением электронов и для их удаления с поверхности металла необходимо затратить энергию – работа выхода иона Uв, которая характеризует термодинамическую устойчивость металла.
В растворе электролита ионы растворенного вещества гидратируются, что сопровождается выделением энергии гидратации Uг.
Когда металл помещается в водный раствор электролита данного металла, возможны два случая: либо ионы переходят с поверхности металла в раствор, либо из раствора выделяются на поверхности металла. Это зависит от соотношения энергии гидратации и работы выхода иона:
ΔU = Uв – Uг.
Если Uг > Uв, то ΔU < 0 и ионы металла переходят в раствор:

или, с точки зрения химизма, можно записать как процесс окисления металла (анодный процесс):

Поверхность металла приобретает отрицательный заряд и возникает электрическое статическое притяжение между ионами металла в растворе и поверхностью металла, т. е. возникает разность потенциалов между металлом и раствором – так называемый электродный потенциал металлов, который при активности ионов металла в растворе, равной 1, и температуре 25°С называется нормальным потенциалом металлов.
Коррозионную устойчивость металла можно оценить по величине нормального потенциала. Если Е0 < –0,414 В, то металлы могут корродировать в нейтральных средах, не содержащих кислорода (щелочные, щелочноземельные элементы). Благородные металлы – палладий, платина, золото – обладают высоким нормальным потенциалом (свыше 0,815 В) и могут корродировать в кислых средах при наличии окислителей.
В процессе электрохимической коррозии на поверхности металла наряду с анодным протекает и катодный процесс – восстановление окислителя (кислорода или катионов водорода):
О2 + 2Н2О + 4е– → 4ОН– (кислородная коррозия);
Н+ + е– → 0,5Н2 (водородная коррозия).
(взрывы в цехах серной кислоты)
Кислородная коррозия протекает в нейтральных и основных растворах, водородная – в кислых (рН ≤ 4).
В качестве электролита могут выступать не только растворы солей, но и пленка воды. Чистая (дистиллированная) вода – плохой проводник электричества, но атмосферная вода проводит электрический ток значительно лучше вследствие химического растворения в ней СО2 и образования электролита Н2СО3, а также за счет содержания в атмосферной воде растворенных солей.
Коррозионная активность особенно возрастает при контакте разнородных металлов, имеющих разные потенциалы (контактная коррозия). Для ее возникновения достаточно включения примесей на поверхности металла.
Рассмотрим в качестве примера электрохимическую коррозию в месте контакта железа и меди под действием атмосферной воды, содержащей растворенный кислород.
Железо окисляется до катионов железа (II), которые переходят в воду:
Fe0
– 2e– = Fe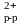 (анодный процесс).
(анодный процесс).
Электроны переходят в медь и восстанавливают кислород:
О2 + 2Н2О + 4е– = 4ОН– (катодный процесс).
В воде ионы Fe2+ и ОН– образуют нерастворимый гидроксид
Fe2+ + 2ОН– = Fe(OH)2.
Далее часть Fe(OH)2 окисляется до метагидроксида железа:
4Fe(OH)2 + O2 = 4FeO(OH) + 2H2O,
который при высыхании капли образует ржавчину – бурый рыхлый порошок:
FeO(OH) + Fe(OH)2 = (FeII, FeIII)2O4 + 2H2О.
Скорость электрохимической коррозии
Скорость электрохимической коррозии зависит от чрезвычайно большого числа факторов. Приведем некоторые из них:
концентрация ионов водорода (рН среды) – каждому металлу присущ свой интервал рН, в котором он максимально устойчив, например талий, молибден, вольфрам устойчивы в кислых средах, но разрушаются в щелочных, никель марганец, железо, медь неустойчивы в кислых средах, но пассивируются в щелочах;
растворимость продуктов коррозии – если продукты коррозии на катодных и анодных участках хорошо растворимы, то скорость коррозии постоянна (например, коррозия железа в растворах хлоридов, сульфатов), в то же время в растворах фосфатов и карбонатов на анодных участках железа образуется плотная пленка нерастворимых продуктов и скорость коррозии резко снижается;
по влиянию на скорость коррозии металлов одни соли становятся активаторами (галогениды щелочных металлов), т. е. способствуют образованию рыхлых пленок, чем значительно увеличивают скорость коррозии; другие же соли являются пассиваторами (хроматы, бихроматы), т. е. окислителями, способствующими образованию плотных пленок;
скорость электрохимической коррозии резко возрастает с ростом концентрации бескислородных кислот (например, НCl);
повышение давления, как правило, вызывает увеличение скорости электрохимической коррозии за счет увеличения содержания кислорода в растворах;
скорость движения потока раствора оказывает сложное влияние: при малых скоростях жидкости скорость коррозии возрастает из-за увеличения поступления деполяризатора – кислорода; в широком интервале скоростей раствора наблюдается пассивация поверхности, т. е. скорость коррозии не зависит от скорости потока; при высоких скоростях поток скорость коррозии возрастает из-за разрушения защитной пленки;
состояние поверхности – полировка, шлифовка приводят к значительному снижению скорости коррозии (меньше трещин, дефектов), в атмосферных условиях вероятность конденсации водяного пара на гладких поверхностях значительно меньше, чем на шероховатых, так коррозионная стойкость полированных образцов стали Х18Н10Т в 6–12 раз выше, чем для грубошлифованных;
механическое напряжение в металле – коррозионному растрескиванию подвержен металл сварного шва, так как в зонах, примыкающих к шву, возникают растягивающие усилия, изменяющие состав и структуру металла, по этой причине не рекомендуется использовать швы внахлестку, швы химической аппаратуры свариваются преимущественно встык.
2.Коррозия и методы защиты от коррозии.
В зависимости от вида коррозии и условий эксплуатации наблюдаются различные виды коррозионных разрушений:
1) сплошная коррозия;
2) местная коррозия.
Сплошная коррозия возникает при отсутствии защитных пленок на поверхности металла или при равномерном распределении анодных и катодных сростков, например при воздействии соляной кислоты на железо, азотной кислоты на медь, щелочей на алюминий. Сплошная коррозия по скорости протекания может быть равномерной и неравномерной.
Потеря прочности пропорциональная уменьшению массы образца, поэтому этот вид коррозии менее опасен.
Для местной коррозии характерно разрушение отдельных участков металла. Различают следующие разновидности местной коррозии:
пятнистая;
язвенная;
точечная;
подповерхностная;
структуроизбирательная;
внутрикристаллическая (межкристаллитная).
Пятнистая коррозия характеризуется большой площадью очагов коррозии и их малой глубиной (этот вид коррозии близок к сплошной).
При язвенной коррозии глубина разрушений превышает их протяженность.
Точечная коррозия часто сопровождается образованием сквозных отверстий. Наблюдается при наличии ионов Cl– и растворенного кислорода. Ее очагами являются примеси, микротрещны, поэтому металлы высокой чистоты и легированные стали менее ей подвержены.
Местная коррозия, в частности точечная, более опасна, чем сплошная, так как прочность образцов снижается в большей мере, чем потеря массы.
При поверхностной коррозии очаг разрушения распространяется под поверхностью металла, что ведет к его вспучиванию и расслоению продуктами коррозии.
Структуроизбирательная коррозия обусловлена разрушением одного из компонентов сплава. К избирательной коррозии относится и межкристаллитная, при которой разрушение идет по границам зерен кристаллов. К ней особенно склонны хромсодержащие стали при температурах свыше 500–800°С, это обусловлено образованием на границе зерен кристаллов карбидов хрома, что, в свою очередь, ведет к снижению содержания хрома на границе зерен (ниже порога устойчивости 12,5%). При содержании углерода не более 0,01% межкристаллитная коррозия не наблюдается.
Разрушение распространяется по кристаллам вглубь металла. Межкристаллитная коррозия – самый опасный вид коррозии, так как значительно снижается прочность металла и трудно контролировать коррозию по потере массы.
Щелевая коррозия – разновидность электрохимической – обусловлена неравномерным гидродинамическим движением реагентов в аппарате. В этом случае образуются застойные зоны в аппарате, концентрация кислорода в которых намного больше ее среднего значения в аппарате, и металл на этих участках становится анодом. На участках, омываемых раствором, металл становится катодом. Способ снижения щелевой коррозии – правильный выбор конструкции аппарата.
Самым надежным способом защиты от коррозии является применение материалов, устойчивых в данных условиях. Причем, наряду с коррозионной устойчивостью, следует учитывать стоимость и доступность материалов. Во многих случаях нет необходимости в использовании дорогостоящих и дефицитных конструкционных материалов: аппараты могут быть изготовлены из дешевой углеродистой стали, но защищены следующими способами:
применение двухслойных сталей – толщина защитного слоя составляет 2–20 мм, основного – 4–100 мм и более;
применение защитных покрытий.
Пленочные защитные покрытия из органических и неорганических материалов используются для защиты от парогазовых сред, в том числе и от атмосферной коррозии.
Способы нанесения:
– многослойная окраска лаками, красками и т. д.;
– гуммирование защищаемой поверхности;
– газопламенное напыление порошкообразных полимерных материалов;
– многократное напыление эмульсии из полимерных материалов с последующей сушкой и спеканием.
Такие покрытия обладают низкой механической прочностью и не могут использоваться при наличии абразивных частиц.
Усиленное защитное покрытие выполняется из термореактивных пластмасс (фаолит, асбовинил и т. п.), кислотостойких замазок, которые при последующей термообработке переходят в твердое состояние. Для увеличения прочности в сырую массу вводят металлическую сетку, приваренную к защищаемой поверхности. Толщина слоя может составлять 10–25 мм. Защитное покрытие на основе органических соединений может применяться до 120°С, на основе силикатных материалов – до 300°С и выше.
Листовое покрытие выполняется из листовых полимерных материалов, сырой или вулканизированной резины. Плиты толщиной 3–6 мм крепятся болтами либо специальным клеем. Листовые полимерные материалы для герметизации склеиваются по швам. Резина приклеивается клеями, содержащими каучук. К недостаткам листовых покрытий относятся следующие:
– нельзя использовать для защиты деталей сложной конфигурации;
– слабая механическая прочность соединения с защищаемым металлом.
Футеровка аппаратуры штучными кислотоупорными изделиями, таким как плитка, блоки, кирпичи на кислотоупорной замазке, может быть однослойными, многослойными и комбинированными. Толщина их составляет 50–500 мм.
Однослойную футеровку применяют для защиты оборудования, работающего с парогазовыми средами, многослойную и комбинированную – в случаях высокой агрессивности среды, высоких температур, больших механических нагрузок и абразивного износа (пром. башни, барботажные выпарные аппараты H2SO4 и Н3РО4, смесители и камеры в производстве суперфосфатов и т. д.). Достоинствами данного вида футеровок являются высокая механическая прочность, высокая рабочая температура (до 400°С), низкая стоимость.
Электрохимические методы защиты от коррозии
Данные методы применяются в случаях, когда металл окружен проводящей средой (электролит, почва, бетон) и не применяются для защиты от атмосферной и газовой коррозии. Электрохимические методы защиты сводятся к искусственной катодной (или анодной) поляризации поверхности металла за счет наложения электрического тока, который сдвигает потенциал поверхности до значения потенциала анода (катода) разомкнутой цепи. Другими словами, изменение потенциала поверхности металла приводит к устранению разности потенциалов между анодным и катодным участками микрогальванопар, тем самым резко снижая скорость коррозии.
Возможны два вида электрохимической защиты:
– с наложением тока (катодная либо анодная);
– протекторная.
При катодной защите с наложением тока ток подводят от внешнего источника постоянного тока (генератора или батареи аккумулятора). Положительный полюс источника тока соединяют со специальным анодным заземлением, через которое ток поступает в среду, воздействующую на металл. Далее ток переходит из окружающей среды на защищаемый металл, поляризует его и поступает через точку дренажа к отрицательному полюсу источника тока. Максимальный защитный потенциал для стальных неизолированных конструкций составляет не менее 0,85 В.
Анодная защита аналогична, но используется, главным образом, для защиты нержавеющей легированной стали, а в результате анодной поляризации на поверхности металла образуется оксидная пленка, пассивирующая металл.
Протекторная защита используется при небольшой поверхности защищаемого металла, но в этом случае ток, необходимый для поляризации поверхности, возникает не за счет внешнего источника, а за счет образования гальванической пары, в которой роль анода-протектора выполняет более электроотрицательный металл, чем металл защищаемый, а катодом является защищаемая поверхность. В качестве анода используют цинк, алюминий, кадмий и их сплавы.
При правильном выборе электрохимической защиты защитный эффект составляет 95–98%. Недостатком ее является то, что защита открытых поверхностей требует большого расхода электрической энергии. Поэтому ее сочетают с изоляцией металла различными покрытиями.
Химические методы защиты
Коррозионное разрушение металла, протекающее по электрохимическому механизму, можно значительно уменьшить использованием ингибиторов. Их целесообразно использовать, когда коррозионная среда имеет постоянный объем или обновляется весьма медленно, т. е. в таких аппаратах как паровые котлы, системы охлаждения замкнутые, а также при консервации металлических изделий.
В качестве ингибиторов используют азот, нитраты, сульфиты щелочных и др. металлов, серосодержащие органические соединения. Для защиты от атмосферной коррозии используют летучие ингибиторы.
Механизм действия части ингибиторов имеет электрохимическую природу и заключается в адсорбции ингибитора на защищаемой поверхности и торможении скорости анодных или катодных процессов.
Другие ингибиторы (так называемые кроющие ингибиторы) образуют на поверхности металла видимые защитные пленки, состоящие из продуктов взаимодействия ингибитора с раствором, металлом или продуктом коррозии. В частности, очень прочные пленки на поверхности железа образуются при их обработке фосфатами (фосфатирование). При взаимодействии кислых фосфатов с поверхностным слоем металла образуется плотный слой средних фосфатов.
Кроющие ингибиторы часто используют в составе лакокрасочных покрытий, а именно вводят в качестве пигмента свинцовый сурик, хроматы цинка и свинца.
Летучие ингибиторы обладают высоким давлением пара и сорбируются на защищаемой поверхности, замедляя анодный процесс. В качестве таких ингибиторов используют соединения различных аминов с органическими и неорганическими кислотами.
3.Принципы защиты от газовой коррозии.
Химическая коррозия наблюдается при действии сухих газов и жидких неэлектролитов на металлы, а также при действии электролитов на неметаллы. Наиболее часто встречающаяся ее разновидность – газовая коррозия – возникает при действии химически активных газов на металлы при повышенных температуре и давлении.
Поверхность металла всегда покрыта оксидной пленкой, образующейся по реакции
Ме + 0,5О2 ↔ МеО.
Когда парциальное давление кислорода в газе больше равновесного давления, то реакция протекает в сторону образования оксида. Если образующиеся пленки прочные, хорошо сцепленные с металлом, то они обладают хорошими защитными свойствами. Такие пленки образуются, если объем оксида металла VМеО незначительно превышает объем окисленного металла VМе. При VМеО < VМе образуется рыхлая, пористая пленка, не обладающая защитными свойствами. Если VМеО >> VМе или они значительно различаются величиной температурных коэффициентов расширения, то в пленке возникают большие внутренние напряжения и она растрескивается, вследствие чего скорость газовой коррозии возрастает.
Что же происходит с различными металлами под действием агрессивных газов? Углеродистые стали при повышенных температурах обезуглероживаются:
Fe3C + O2 → 3Fe + CO2;
Fe3C + СO2 → 3Fe + 2CO;
Fe3C + Н2O → 3Fe + CO + Н2,
либо за счет гидрирования происходит водородная коррозия
Fe3C + 2Н2 → 3Fe + CН4.
В результате снижаются механическая прочность и предел устойчивости. Устойчивость к водородной коррозии возрастает при введении хрома, титана, молибдена, ванадия.
Разновидностью газовой коррозии является карбонильная коррозия:
Ме + nCO ↔ Ме(СО)n,
которая наблюдается при высоких давлениях и невысоких температурах. Устойчивость различных сталей к карбонильной коррозии в зависимости от температуры имеет вид, представленный на рис.___. Практически не подвергается карбонильной коррозии алюминий.
Сернистые соединения и пары серы при повышенных температурах вызывают коррозию многих металлов, особенно опасен сероводород.
Введение в стали алюминия в количестве не менее 4% повышает их устойчивость к сернистым соединениям до температуры 800°С. Стойкость сталей к газовой коррозии возрастает и при введении в них кремния.
Скорость химической коррозии в зависимости от различных факторов выражается уравнением
v = kFΔCn, г/ч,
где С – концентрация коррозионноактивного компонента.
Пленочные защитные покрытия из органических и неорганических материалов используются для защиты от парогазовых сред, в том числе и от атмосферной коррозии.
Способы нанесения:
– многослойная окраска лаками, красками и т. д.;
– гуммирование защищаемой поверхности;
– газопламенное напыление порошкообразных полимерных материалов;
– многократное напыление эмульсии из полимерных материалов с последующей сушкой и спеканием.
Такие покрытия обладают низкой механической прочностью и не могут использоваться при наличии абразивных частиц.
4.Методы защиты от коррозии.
Электрохимические методы защиты от коррозии
Данные методы применяются в случаях, когда металл окружен проводящей средой (электролит, почва, бетон) и не применяются для защиты от атмосферной и газовой коррозии. Электрохимические методы защиты сводятся к искусственной катодной (или анодной) поляризации поверхности металла за счет наложения электрического тока, который сдвигает потенциал поверхности до значения потенциала анода (катода) разомкнутой цепи. Другими словами, изменение потенциала поверхности металла приводит к устранению разности потенциалов между анодным и катодным участками микрогальванопар, тем самым резко снижая скорость коррозии.
Возможны два вида электрохимической защиты:
– с наложением тока (катодная либо анодная);
– протекторная.
При катодной защите с наложением тока ток подводят от внешнего источника постоянного тока (генератора или батареи аккумулятора). Положительный полюс источника тока соединяют со специальным анодным заземлением, через которое ток поступает в среду, воздействующую на металл. Далее ток переходит из окружающей среды на защищаемый металл, поляризует его и поступает через точку дренажа к отрицательному полюсу источника тока. Максимальный защитный потенциал для стальных неизолированных конструкций составляет не менее 0,85 В.
Анодная защита аналогична, но используется, главным образом, для защиты нержавеющей легированной стали, а в результате анодной поляризации на поверхности металла образуется оксидная пленка, пассивирующая металл.
Протекторная защита используется при небольшой поверхности защищаемого металла, но в этом случае ток, необходимый для поляризации поверхности, возникает не за счет внешнего источника, а за счет образования гальванической пары, в которой роль анода-протектора выполняет более электроотрицательный металл, чем металл защищаемый, а катодом является защищаемая поверхность. В качестве анода используют цинк, алюминий, кадмий и их сплавы.
При правильном выборе электрохимической защиты защитный эффект составляет 95–98%. Недостатком ее является то, что защита открытых поверхностей требует большого расхода электрической энергии. Поэтому ее сочетают с изоляцией металла различными покрытиями.
Химические методы защиты
Коррозионное разрушение металла, протекающее по электрохимическому механизму, можно значительно уменьшить использованием ингибиторов. Их целесообразно использовать, когда коррозионная среда имеет постоянный объем или обновляется весьма медленно, т. е. в таких аппаратах как паровые котлы, системы охлаждения замкнутые, а также при консервации металлических изделий.
В качестве ингибиторов используют азот, нитраты, сульфиты щелочных и др. металлов, серосодержащие органические соединения. Для защиты от атмосферной коррозии используют летучие ингибиторы.
Механизм действия части ингибиторов имеет электрохимическую природу и заключается в адсорбции ингибитора на защищаемой поверхности и торможении скорости анодных или катодных процессов.
Другие ингибиторы (так называемые кроющие ингибиторы) образуют на поверхности металла видимые защитные пленки, состоящие из продуктов взаимодействия ингибитора с раствором, металлом или продуктом коррозии. В частности, очень прочные пленки на поверхности железа образуются при их обработке фосфатами (фосфатирование). При взаимодействии кислых фосфатов с поверхностным слоем металла образуется плотный слой средних фосфатов.
Кроющие ингибиторы часто используют в составе лакокрасочных покрытий, а именно вводят в качестве пигмента свинцовый сурик, хроматы цинка и свинца.
Летучие ингибиторы обладают высоким давлением пара и сорбируются на защищаемой поверхности, замедляя анодный процесс. В качестве таких ингибиторов используют соединения различных аминов с органическими и неорганическими кислотами.
