
Семинары / Семинар термодинамика растворов
.pdf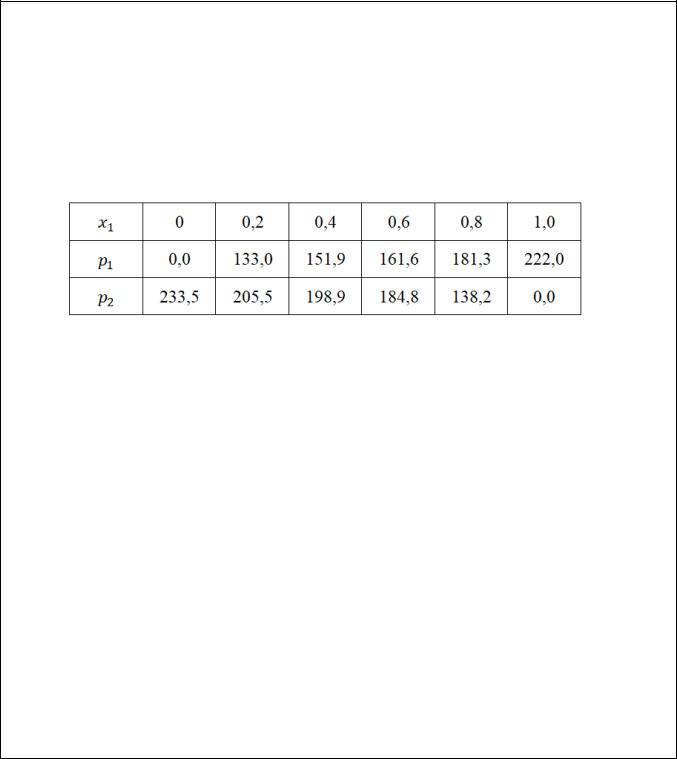
|
= |
1 |
= |
0,865 |
|
= , |
||
|
|
|
||||||
1 |
|
1 |
0,8 |
|
|
|||
|
|
|
|
|||||
и спирта: |
|
|
|
|
|
|
|
|
|
= |
2 |
|
= |
0,269 |
= , |
||
|
|
|
||||||
2 |
|
2 |
0,2 |
|
|
|||
|
|
|
|
|||||
Задачи для самостоятельного решения:
Задача 14.
Давление пара (в мм рт. ст.) с системе 2 5 (1) − 2 4 2 (2) при
50°С имеет следующие значения:
Определите активность и коэффициент активности каждого компонента в растворе с концентрацией 2 = 0,6.
Ответ: 1 = 0,684 , 1 = 1,7102 = 0,852 , 2 = 1,420
Задача 15.
На основании справочных данных (Р., табл. 20, стр. 26) о парциальном давлении пара компонентов в системе этанол (1) – бензол (2) рассчитайте активности и коэффициенты активности каждого компонента в растворе с концентрацией 55 %мол. этанола.
Ответ: 1 = 0,734 , 1 = 1,3352 = 0,848 , 2 = 1,884
11

Коллигативные свойства разбавленных растворов
Задачи на эту тему весьма разнообразны. Но все они решаются с использованием определенного набора формул:
1. Понижение давления насыщенного пара растворителя над раствором.
° |
− |
|
1 |
1 |
= |
|
° |
|
|
2 |
|
|
1 |
|
Связь мольной доли растворенного вещества с его молярной массой:
2 ≈ 2 ∙ 12 ∙ 1
2. Повышение температуры кипения раствора.
∆кип =
Эбуллиоскопическая постоянная растворителя:
|
2 |
|
= |
кип.,1 |
1 |
1000 ∆ |
|
|
|
исп 1 |
|
Связь моляльной концентрации раствора с молярной массой растворенного вещества:
1000
= 2 1
3.Понижение температуры замерзания (отвердевания) раствора.2
∆отв =
Криоскопическая постоянная растворителя:
|
2 |
|
= |
пл.,1 |
1 |
1000 ∆ |
|
|
|
пл. 1 |
|
4. Осмотическое давление.
=
12

Связь молярной концентрации раствора с молярной массой растворенного вещества и плотностью раствора:
= |
|
2 |
= |
2 ∙ р−ра |
|
|
|
|
( |
+ |
) |
||
2 |
р−ра |
|
2 1 |
2 |
||
Связь изотонического коэффициента Вант-Гоффа со степенью диссоциации растворенного вещества:
= 1 + ( − 1)
Обозначения:
1 – давление паров растворителя над раствором;
1° – давление насыщенного пара над чистым растворителем;
∆кип – повышение температуры кипения раствора;
∆отв – понижение температуры замерзания раствора;
– осмотическое давление
– эбуллиоскопическая постоянная растворителя;
– криоскопическая постоянная растворителя;
кип.,1 – температура кипения чистого растворителя;
пл.,1 – температура плавления чистого растворителя;
∆исп 1 – мольная теплота испарения чистого растворителя;
∆пл. 1 – мольная теплота плавления чистого растворителя
2 – мольная доля растворенного вещества в растворе;
– моляльная концентрация раствора;
– молярная концентрация раствора;
1 – масса растворителя в растворе;
2 – масса растворенного вещества в растворе;
1 – молярная масса растворителя;
2 – молярная масса растворенного вещества;
р−ра – объём раствора (р−ра = р−ра = ( 1+ 2));
р−ра р−ра
р−ра – плотность раствора.
13

Задача 16
Определите степень диссоциации йодноватой кислоты 3 (2) в этиловом спирте 2 5 (1). Раствор содержит 0,506 г 3 и 22,48 г 2 5 .
Температура кипения раствора составляет 351,624 К, а температура кипения чистого спирта – 351,46 К. Молярная теплота испарения этанола 39,73 кДж/моль.
Решение
Запишем формулу для расчета степени диссоциации. Её можно выразить из уравнения для изотонического коэффициента Вант-Гоффа:
= 1 + ( − 1)
− 1= − 1
Для нахождения нам необходима величина изотонического коэффициента. Изотонический коэффициент входит в выражения всех коллигативных свойств. В условии задачи приведены температуры кипения раствора и растворителя. Поэтому выбираем формулу для расчета повышения температуры кипения:
∆кип =
Отсюда
= ∆кип
Найдем ∆кип
∆кип = кип р−ра − кип.,1 = 351,624 − 351,46 = 0,164 К
где кип.,1 – температура кипения чистого растворителя (спирта).
Теперь надо найти эбуллиоскопическую постоянную и моляльную
концентрацию раствора.
Эбуллиоскопическая постоянная спирта:
|
2 |
|
= |
кип.,1 |
1 |
1000 ∆ |
|
|
|
исп 1 |
|
14

1 – молярная масса растворителя, 1 = 46 мольг ;
∆исп 1 – молярная теплота испарения чистого растворителя. Согласно условию,
∆ |
|
= 39730 |
|
Дж |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
исп |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
1 |
моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Подставляем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
2 |
|
|
|
|
|
|
8,314 ∙ (351,46)2 ∙ 46 |
|
|
|
К ∙ кг |
||||||||||||||||||||
|
|
= |
|
|
кип.,1 |
1 |
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= 1,189 |
|
|
|
|||||
|
|
|
1000 ∆ |
|
|
|
|
|
|
|
|
1000 ∙ 39730 |
|
|
моль |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
исп 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Моляльная концентрация раствора: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
2 1000 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1, 2 – навески растворителя и растворенного вещества в граммах |
|||||||||||||||||||||||||||||||||||
|
|
1 = 22,48 г, 2 = 0,506 г согласно условию. |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
– молярная масса растворенного вещества , |
= 176 |
г |
. |
||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
2 |
|
|
моль |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Находим : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
= |
2 1000 |
|
= |
|
0,506 ∙ 1000 |
= 0,128 |
моль |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
176 ∙ 22,48 |
|
кг |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Теперь можно найти изотонический коэффициент: |
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
= |
∆ кип |
= |
|
|
|
0,164 |
|
|
|
|
= 1,078 |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
1,189 ∙ 0,128 |
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
Тогда степень диссоциации: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
= |
|
− 1 |
= |
1,078 − 1 |
= , |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
− 1 |
|
2 − 1 |
|
|
|
|
|
||||||||||||||||||||
|
|
( = 2, потому |
|
что |
молекула |
3 |
|
при |
растворении может |
||||||||||||||||||||||||||
диссоциировать на две частицы: катион + и анион 3−.)
Таким образом, йодноватая кислота при растворении в этиловом спирте диссоциирует на 7,8 %
15

Задача 17
Раствор, содержащий 0,81 г углеводорода в 190 г бромистого этила, замерзает при температуре 9,47 . Температура плавления бромистого этила составляет 10 . Его криоскопическая постоянная 12,5 мольК∙кг . Определите
молярную массу углеводорода, растворенного в бромистом этиле. Примите, что
= 1.
Решение
В условии задачи приведены данные для определения молярной массы растворенного вещества криоскопическим методом.
Молярная масса растворенного вещества входит в выражении моляльности
раствора: |
|
|
|
|
|
|
|
= |
2 1000 |
||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|
|
|
Выразим отсюда 2: |
|
|
|
|
|
|
|
|
|
= 2 1000 |
|||||
2 |
|
|
1 |
|
|||
|
|
|
|
||||
Навески растворителя 1 и |
растворенного вещества 2 нам известны. |
||||||
Моляльность найдем из формулы для расчета понижения температуры замерзания (отвердевания) раствора:
∆ отв =
= 1, поэтому можно записать:
= ∆ отв
∆ отв = отв.р−ра − пл.,1 = (10 + 273) − (9,47 + 273) = 0,53 К
где пл.,1 – температура плавления (т.е. и отвердевания) чистого растворителя (бромистого этила).
Тогда моляльность:
= ∆ отв = 0,5312,5 = 0,0424 молькг
имолярная масса растворенного углеводорода:
|
= |
2 1000 |
= |
0,81 ∙ 1000 |
≈ |
г |
|
|
|
||||
2 |
|
1 |
0,0424 ∙ 190 |
моль |
||
|
|
|||||
16

Задача 18
Найдите осмотическое давление раствора хлорида меди (II) 2 с общей молярной концентрацией 0,02 моль/л при температуре 50 . Кажущаяся степень диссоциации соли в этом растворе равна 95 % ( = 0,95).
Решение |
|
|
Осмотическое давление находится по формуле: |
|
|
= |
|
|
Для раствора хлорида меди ≠ 1, так как растворенное |
вещество |
|
диссоциирует на ионы. |
|
|
Найдем изотонический коэффициент Вант-Гоффа , учитывая, |
что |
= |
0,95 , а = 3 ( 2 при растворении диссоциирует на три частицы: один катион + и два аниона −):
= 1 + ( − 1) = 1 + 0,95 ∙ (3 − 1) = 2,9
Теперь найдем осмотическое давление. Здесь важно учитывать единицы измерения подставляемых в уравнение величин. Если использовать систему СИ,
то осмотическое давление мы получим в Па. Молярную концентрацию при этом необходимо перевести в [мольм3 ]. Температуру переводим в Кельвины:
= = 2,9 ∙ (0,02 ∙ 103) |
моль |
|
∙ 8,314 |
Дж |
|
|
∙ 323 К = Па |
||||||
|
|
моль ∙ К |
|||||||||||
|
|
|
м3 |
|
|
|
|||||||
Осмотическое давление можно получить и в атм: |
|
||||||||||||
= = 2,9 ∙ 0,02 |
моль |
∙ 0,082 |
л ∙ атм |
∙ 323 К = , атм |
|||||||||
|
|
|
|
|
|||||||||
л |
|
|
моль ∙ К |
||||||||||
17

Задачи для самостоятельного решения
Задача 19
Теплота испарения воды при нормальной температуре кипения (373 К) равна
40593 Дж/моль. найдите повышение температуры кипения раствора, содержащего
0,025 моль растворенного нелетучего вещества в 2000 г воды. Принять, что изотонический коэффициент Вант-Гоффа равен 1.
Ответ: 0,0064 К.
Задача 20
Криоскопическая постоянная бензола |
= 5,07. Понижение температуры |
замерзания раствора, содержащего 0,02 моль |
некоторого вещества в 250 г бензола, |
составляет 0,17 . Найдите изотонический коэффициент Вант-Гоффа.
Ответ: 0,42.
Задача 21
Рассчитайте осмотическое давление разбавленного сантимолярного водного раствора нитрата калия при 300 К, если кажущаяся степень диссоциации электролита составляет 90 %.
Ответ: 0,467 атм.
18
