
- •Загальна характеристика ароматичних амінів. Характеристика лікарського засобу (за схемою вивчення) - похідного п- амінофенолу - парацетамолу.
- •Загальна характеристика амідів сульфанілової кислоти (сульфаніламідних лікарських засобів),стрептоциду, сульфацил-натрію, норсульфазолу, сульфадимезину, сульфадиметоксину, сульфалену.
- •Загальна характеристика ароматичних амінокислот. Естери /і-амінобензойної кислоти: Анестезин, Новокаїн, дикаїну.
- •Утворення азобарвника.
- •4. Реакції на ацетил.
- •Вихідною речовиною для отримання сульфаніламідних лз є кислота сульфанілова.
- •1. Реакції, обумовлені Гідрогеном сульфамідної групи.
- •На підставі іч-спектроскопії.
- •За температурою плавлення.
- •1.2. Лігнінова проба – утворення основ Шиффа.
- •2.Специфічна реакція – на наявність сульфамідної групи (реакція, обумовлена Гідрогеном сульфамідної групи):
- •Фталазол (Phthalazolum)
- •1.2. Лігнінова проба – утворення основ Шиффа оранжево-червоного забарвлення.
- •2. Реакція на наявність сульфамідної групи.
- •Сульфадиметоксин (Sulfadimethoxinum)
- •1.2. Лігнінова проба – утворення основ Шиффа.
- •2. Специфічна реакція:
- •1.2. Лігнінова проба – утворення основ Шиффа оранжево-червоного забарвлення.
Вихідною речовиною для отримання сульфаніламідних лз є кислота сульфанілова.
Сульфанілова кислота не є ЛЗ , але її амід є лікарським препаратом (стрептоцид) та слугує джерелом для отримання великої кількості лікарських засобів , об`єднаних за своєю хімічною будовою і за фармакологічною дією в одну групу сульфаніламідних лікарських засобів :

сульфанілова амід сульфані- загальна
кислота лової к-ти формула
бензолсульфо- стрептоцид де R – різні замісники.
кислота
Сульфаніламідні лікарські засоби – це похідні аміду сульфанілової кислоти.
Амід сульфанілової кислоти вперше був синтезований в 1908 році французьким хіміком Гельмо як джерело для отримання барвника, але тільки 27 років потому була встановлена його хіміотерапевтична активність. В 1935 році в дослідах на мишах, заражених гемолітичним стрептококом, була виявлена хіміотерапевтична дія пронтозилу- червоного стрептоциду.
Це відкриття стало початком нового етапу в розвитку хіміотерапії.
Основним завданням хіміотерапії є пошук засобів боротьби з інфекційними хворобами. Хіміотерапевтичними засобами називають такі речовини, які вибірково діють на патогенні мікроорганізми і майже не діють в тих же концентраціях на макроорганізм.
Висока активність сульфаніламідних препаратів при лікуванні захворювань, при яких спостерігалась висока смертність ( запалення легень, менінгіт та ін.), викликала велику зацікавленість до цих сполук вчених багатьох країн.
Пізніше вченими було встановлено, що пронтозил в організмі перетворюється до сульфаніламіду, тобто хіміотерапевтична дія пронтозилу обумовлена наявністю в його молекулі аміду сульфанілової кислоти ( стрептоциду).
З цього часу n-амінобензолсульфамід (амід сульфанілової кислоти – стрептоцид) отримав визнання у всьому світі.
Таким чином, стрептоцид є родоначальником всієї групи сульфаніламідних препаратів, на основі якого шляхом заміщення на різні радикали Гідрогену в сульфамідній групі (положення 1) та ароматичній аміногрупі (положення 4 ) була отримана велика кількість сульфаніламідних лікарських засобів з різною мірою терапевтичної активності:

Більшість сульфаніламідних ЛЗ є первинними ароматичними амінами (R′=H), за виключенням розчинного стрептоциду, фталазолу та ін.
Гідроген в сульфамідній групі може бути заміщений радикалами (R) аліфатичної або гетероциклічної структури. При заміщені R та R' на атом Гідрогену або відповідну групу були отримані наступні препарати:
Класифікація сульфаніламідних препаратів (за радикалами):
1 Аліфатичні (R) похідні Стрептоцид, Стрептоцид розчинний, Сульфацил –натрій
2. Гетероциклічні (R) похідні Норсульфазол, Сульфадимезин, Сульфадиметоксин, Сульфален
3. Ароматичні (R1) і гетероциклічні (R) похідні Фталазол
Добування.
Оскільки в основі сульфаніламідів лежить одна й та ж структура – сульфаніламідний залишок :

схема синтезу їх приблизно однакова. Вихідною речовиною для добування служить сульфанілова кислота. Синтез здійснюють за відповідною схемою.
Метод 1. Синтез з ацетаніліду. Цей метод складається з трьох основних стадій.
1) Сульфування
ацетаніліду
хлорсульфоновою кислотою (хлорангідридом
сульфатної кислоти HO–SO2–Cl)
з отриманням хлорангідридуацетилсульфанілової кислоти:
![]()
2) Конденсація
продукту з амоніаком NH3 або
відповідним аміном R–NH2 з
утворенням ацетилсульфаніламідів:
![]()
3) Омилення ацильної групи (оскільки ацильовані сульфаніламіди
терапевтичного ефекту не мають) шляхом
кип'ятіння з мінеральними
кислотами (HCl,H2SO4 –
кислотний гідроліз) або лугом (отримують Na–сіль
сульфаніламіду).
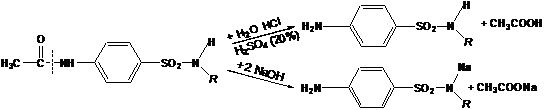
Метод
2. Синтез
із сульфанілової кислоти
сульфанілова кислот Na п-амінобензолсуфонат ацилування H2N-групи
![]()
Na п-ацетиламінобензолсульфонат п-ацетиламінобензолсульфохлорид
![]()
Алкіламід п-N-ацетилсульфанілової кислоти алкілсульфаніламід
Метод 3 Синтез з фосгену та аніліну (найбільш раціональний і економічний) З фосгену Cl–CO–Cl (отруйний газ) і аніліну C6H5NH2 отримують карбметоксианілід*.
Одночасно з синтезом сульфаніламідних препаратів проводилася робота по встановленню зв`язку між хімічною будовою сульфаніламідів та їх фізіологічною дією.
Основні закономірності між хімічною будовою та їх фізіологічною дією:
1. Фізіологічна активність обумовлена наявністю сульфанільного радикалу в молекулі:
![]()
2. Переміщення аміногрупи з положення 4 в інші положення ароматичного ряду призводить до повної втрати фізіологічної активності
3. Будь-який похідний сульфаніламіду з заміщеною аміногрупою може бути фізіологічно активним тільки тоді, коли в організмі може знову утворюватися вільна аміногрупа;
4. Введення радикалів в сульфамідну групу (—SO2NH2) зменшує або підвищує фізіологічну активність;
5. Для тривалої дії має значення наявність в молекулі метоксильних груп (майже всі препарати тривалої дії на відміну від препаратів короткої дії мають метоксильні групи (-OCH3) в гетероциклічному ядрі – R). Припускають, що метоксигрупа визначає більш високий процент зв`язування сульфаніламіда з білками крові, що зумовлює тривалість дії препарату.
Опис і розчинність. Сульфаніламідні лікарські засоби являють собою білі або білі з жовтуватим відтінком кристалічні речовини без запаху. Кислотні форми малорозчинні у воді, спирті, ефірі. Деякі сульфаніламіди розчинні в ацетоні. Натрієві солі добре розчинні у воді і не розчинні в органічних розчинниках.
Хімічні властивості сульфаніламідів та ідентифікація
Більшість сульфаніламідних речовин – амфотерні сполуки – у них виражені як кислотні, так і основні властивості..
Основні властивості зумовлені атомом Нітрогену первинної ароматичної аміногрупи (-NH2) (центр основності) - атом Нітрогену має неподілену пару електронів і може приєднувати протон .
Як основи вони розчиняються в кислотах, приєднуючи протон за рахунок неподіленої пари електронів Нітрогену ароматичної аміногрупи, утворюючи солі:
![]()
Однак солі їх у водних розчинах сильно гідролізовані і практично не існують.
Кислі властивості зумовлені рухомим атомом Гідрогену сульфамідної групи –SO2-NH- (центр кислотності) , який може заміщуватися на метали з утворенням солей (NH-кислоти). Тому лікарські засоби легко розчиняються в лугах і в карбонатах лужних металів:
![]()
сульфамідна
група
Кислі властивості виявлені сильніше, ніж основні. Отже, сульфаніламіди – це амфоліти з переважанням кислотних властивостей.
Натрієві солі сульфаніламідів добре розчинні у воді, при цьому внаслідок гідролізу їх водні розчини мають лужну реакцію.
Ідентифікація сульфаніламідів
Подiбнiсть хiмiчної будови сульфанiламiдiв зумовлює подiбнiсть їхнiх властивостей та можливiсть застосування спiльних (загальних) методiв аналiзу для цiєї групи лiкарських засобiв.
Для ідентифікації сульфаніламідних лікарських засобів використовують загальні та індивідуальні (специфічні) реакції ідентифікації. Специфiчнi методи аналiзу визначаються характером радикалiв у сульфамiднiй групi та ароматичнiй амiногрупi.
Спільні реакції ( загальні реакції )
В основному обумовлені двома функціональними групами: первинною ароматичною аміногрупою (-NH2) і сульфамідною групою (-SO2-NH-):
 сульфамідна
група
сульфамідна
група
Первинна ароматична аміногрупа
Деякі реакції притаманні і ароматичному кільцю.
1. Реакції, обумовлені первинною ароматичною аміногрупою (реакції ідентифікації на первинну ароматичну аміногрупу):
1.1. Реакція діазотування з наступним азосполученням з фенолами – реакція утворення азобарвника..
При дії на сульфаніламіди натрію нітритом NaNO2 в кислому середовищі утворюється сіль діазонію, яка при наступному сполученні з фенолом ( розчином β-нафтолу) в лужному середовищі утворює азобарвник. У результаті реакції з`являється вишнево-червоне забарвлення або випадає осад оранжево- червоного кольору:

сіль діазонію β-нафтол азобарвник
Це загальна реакція не тільки на сульфаніламіди, але й на всі сполуки, які мають в молекулі незаміщену первинну ароматичну аміногрупу.
Препарати, в яких аміногрупа заміщена радикалом (стрептоцид розчинний, фталазол) спочатку гідролізують кип`ятінням з розведеною хлористоводневою кислотою.
Це є фармакопейна реакція на первинні ароматичні аміни.
1.2. Реакція конденсації з альдегідами (утворення основ Шифа).
Сульфаніламіди, як і інші ароматичні аміни, з багатьма альдегідами утворюють забарвлені продукти конденсації - основи Шифа:

сульфаніламід альдегід
На цьому ж принципі конденсації ароматичної аміногрупи з альдегідами ґрунтується крапельна реакція , яка використовується в експрес-аналізі (для внутрішньоаптечного контролю в аптеці). Називається ця реакція лігнінова проба.
Лігнінова проба:
Кiлька крупинок або 1—2 краплi розчину дослiджуваного сульфанiламiду помiщають на невибiлений газетний папiр, добавляють краплю розбавленої хлористоводневої кислоти; спостерiгається жовто-оранжеве забарвлення.
В результатi гiдролiзу лiгнiну, що мiститься в паперi, утворюються ароматичнi альдегiди, якi з первинною ароматичною амiногрупою утворюють шиффовi основи.
2. Реакції обумовлені сульфамідною групою.
Всі сульфаніламіди мають в своєму складі Сульфур сульфамідної групи - (-SO2-NH-).
Для виявлення атому Сульфуру в сульфамідній групі лікарський засіб мінералізують (руйнують) кислотою нітратною концентрованою. В результаті Сульфур переходить в сульфати,які визначають за реакцією з розчином барію хлориду:
![]()
3. Реакції , обумовлені ароматичним ядром.
Усі сульфаніламіди можуть галоїдуватися, нітруватися, сульфуватися по ароматичному кільцю (реакція електрофільного заміщення атомів Гідрогену бензольного кільця на галоген).
Наявність в молекулах сульфаніламідів замісника І роду – аміногрупи, яка за рахунок спряження неподіленої електронної пари Нітрогену з π-електонами ароматичної системи призводить до перерозподілу електронної густини в кільці і активізації ароматичного кільця в о- та п-положеннях (за рахунок створення надлишкового негативного заряду) , надає здатність атомам Гідрогену бензольного ядра в цих положеннях легко заміщуватися на бром :

Специфічні реакції
