
Консультации к кр / Фазовое равновесие 1
.pdf
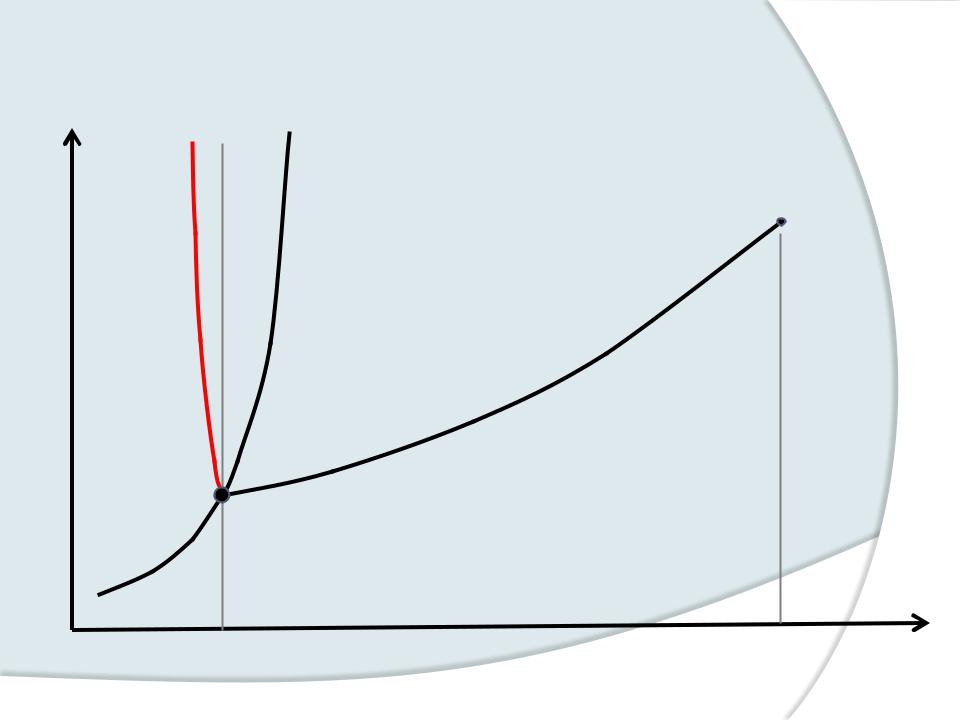
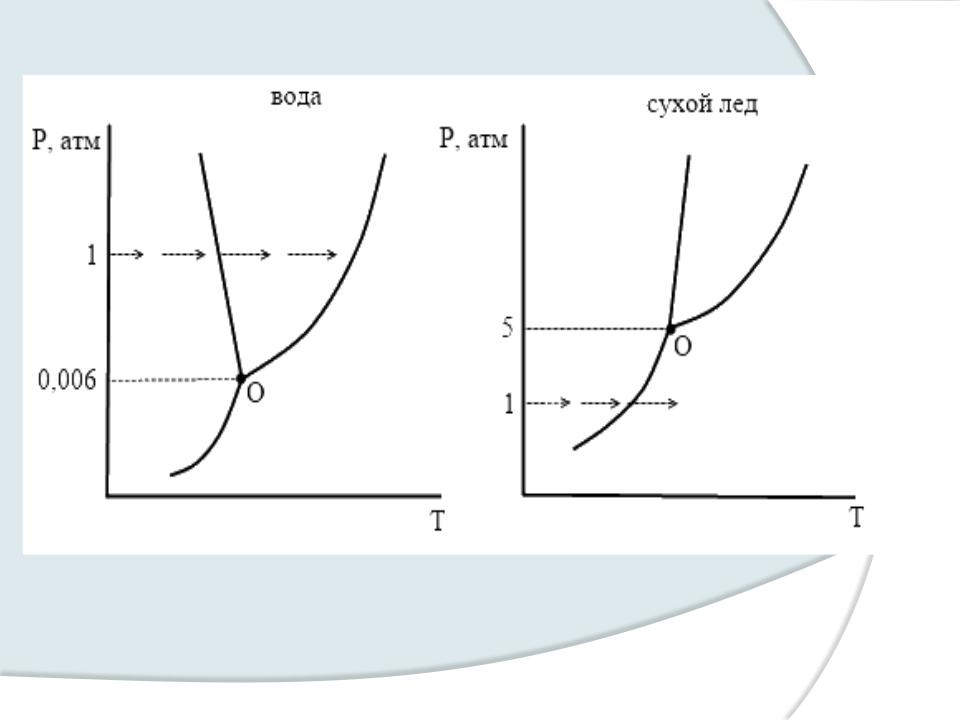
Диаграмма фазового состояния
Р |
В’ |
В |
Жидкость |
К |
|
Тв.
Газ
О
А
Т Т.Т. |
Т КР. T |
Вариантность системы
Число степеней свободы – число параметров (внешних или внутренних) – Р, Т, Сi и т.п., которые можно произвольно изменять, не изменяя числа и вида фаз системы.
Правило фаз Гиббса: Число степеней свободы f (вариантность состояния) равновесной термодинамической системы, на которую из внешних факторов влияют только р и Т, равно числу независимых компонентов минус число фаз плюс два.
f= K – Ф + n
Врассматриваемом случае на равновесие оказывают влияние только давление и температура, поэтому n = 2
f = K – Ф + 2

Уравнение Клапейрона
dP ФП Н dT ТФП ФПV
Анализ уравнения Клапейрона
Анализируя его, определяем знак
производной (по правой части
уравнения):
-абсолютная температура всегда
положительна,
-тепловой эффект прямого перехода положителен,
-знак производной может
определяться знаком изменения
объема .

Для процесса испарения (возгонки)
уравнение Клапейрона-Клаузиуса
d ln P |
|
|
исп |
H |
|
|
|
||
|
|
|
|
|
dT |
|
RT |
2 |
|
|
|
|||
1.В случае равновесия жидкость (тв.) газ при температурах далеких от критической
|
Vг >> Vж |
||
Следовательно, |
испV = Vг = V |
||
2. Пар - идеальный газ |
V |
R T |
|
|
P |
||
|
|
||

Алгоритм решения задач
Определяем, какой процесс задан в условии.
Испарение, возгонка (конденсация)
Используем уравнение Клапейрона-Клаузиуса
|
Данные: температурная |
|
Данные: два давления |
|||
|
|
зависимость |
|
при двух температурах |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дифференциальные формы уравнения
d ln P |
|
|
исп |
H |
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
dT |
|
|
RT |
2 |
|
|
|
|
|
|
|
|||
|
dP |
|
исп H |
P |
|||
|
dT |
|
RT 2 |
|
|||
Интегральные формы уравнения
|
P2 |
|
исп H |
1 |
|
1 |
|
|
ln |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
P |
|
R |
T |
|
T |
|
|
|
1 |
|
|
|
1 |
|
2 |
|
ln P исп H const RT
Плавление
Используем уравнение Клапейрона
dP пл Н dT Тпл плV
или
P плН
T Тпл плV

Термодинамические функции фазовых переходов
Изменение энергии Гиббса |
Изменение энтропии |
|
|
Теплота фазового перехода |
|
1 Испарение, возгонка (конденсация) |
|
а) Средняя теплота испарения (возгонки) |
|
Аналитический расчет |
Графический расчет |
Давления при двух температурах или даны, или берем из справочника (таблица 24)
б) Истинная теплота испарения (возгонки)
Аналитический расчет Графический расчет
При решении задач на плавление
|
= |
∆пл |
∆ |
= |
∆пл |
|
пл∙∆пл |
∆ |
пл ∙ ∆пл |
Подставляя числовые значения в эти уравнения важно помнить о согласовании
единиц измерения!
В частности, чтобы получить давление в Па (система СИ), необходимо перевести
объем в м3 .
Также проверяем, в каких единицах измеряется изменение объема и теплота
плавления (удельные или мольные величины).
Поэтому ОБЯЗАТЕЛЬНО при решении таких задач проставляем единицы
измерения при подстановке чисел в формулу.
Например:
∆ |
|
∆пл |
|
120 |
Дж |
|
|
|
Па |
||
|
= |
|
|
|
|
= |
г |
|
3 |
= 6,74 ∙ 106 |
|
∆ |
|
∙ ∆ |
|
|
|
К |
|||||
|
пл |
40,9 + 273 К ∙ (5,67 ∙ 10−2 |
∙ 10−6) |
м |
|
||||||
|
|
пл |
|
|
г |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|

Правило Трутона
Теплоты испарения различных жидкостей закономерно связаны с их нормальными температурами кипения.
Существует эмпирическое правило, которое носит название правила
Трутона:
Мольные энтропии испарения неполярных неассоциированных жидкостей при нормальной температуре кипения примерно одинаковы
и в среднем составляют:
Это правило выполняется только для неполярных,
неассоциированных в паровой фазе жидкостей и только при
нормальной температуре кипения, которая у каждого вещества
единственная.
