
- •Карбонові кислоти
- •Монокарбонові насичені кислоти
- •Номенклатура та ізомерія
- •Способи одержання карбонових кислот
- •1. Окиснення
- •Окиснення алканів киснем повітря або чистим о2.
- •1.2. Реакція оксосинтезу (карбонілування)
- •2. Гідроліз
- •2.2. Гідроліз нітрилів у кислому або лужному середовищах
- •2.3. Гідроліз естерів і жирів
- •3. Одержання за допомогою металоорганічних сполук
- •Фізичні властивості
- •Хімічні властивості
- •1. Кислотні властивості карбонових кислот
- •2. Утворення галогенангідридів (ацилгалогенідів)
- •3. Утворення ангідридів
- •4. Утворення амідів
- •5. Утворення естерів (реакції естерифікації)
- •Окремі представники
- •Монокарбонові ненасичені кислоти
- •Хімічні властивості
- •1. Приєднання галогеноводнів
- •Реакції полімеризації
- •Поняття про ліпіди
- •Ароматичні Одноосновні карбонові кислоти
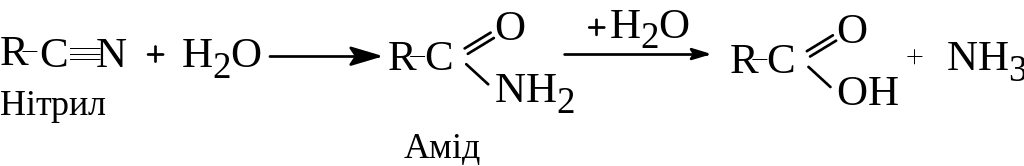
- •2.1. Гідроліз нітрилів
- •2.2. Гідроліз гем-тригалогенопохідних
- •Дикарбонові насичені та ненасичені кислоти
- •Насичені двоосновні кислоти
- •4.1. Синтези одноосновних кислот
- •4.2. Синтез двоосновних кислот
- •Ненасичені двоосновні кислоти
- •Аренодикарбонові та аренополікарбонові кислоти
1. Кислотні властивості карбонових кислот
Завдяки високій поляризованості зв'язку О-Н кислоти здатні до дисоціації за схемою

Карбоксилат-йон
О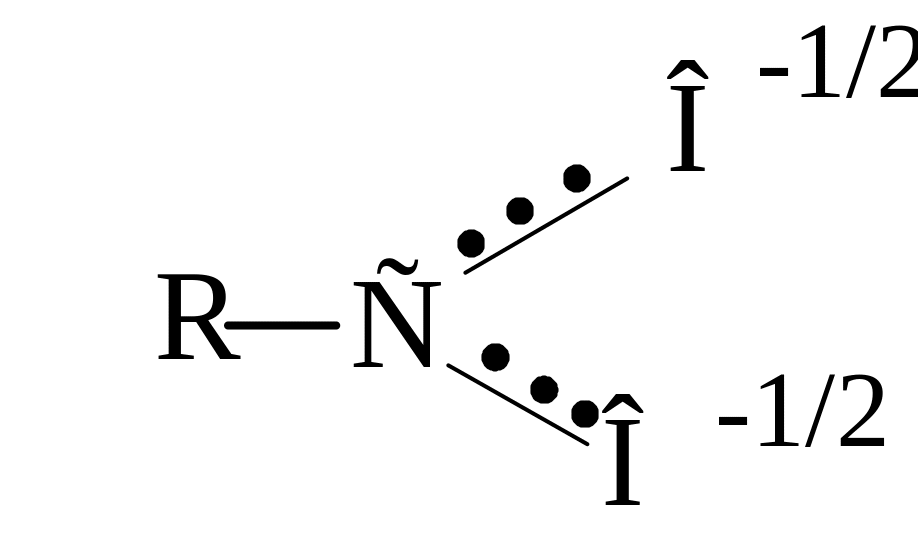 бидва
атоми кисню у карбоксилат-йоні знаходяться
на однаковій віддалі від атома вуглецю
і електронна густина рівномірно
розподілена між ними. Чотири p-електрони
делокалізовані мід трьома ядрами атомів
кисню і вуглецю.
бидва
атоми кисню у карбоксилат-йоні знаходяться
на однаковій віддалі від атома вуглецю
і електронна густина рівномірно
розподілена між ними. Чотири p-електрони
делокалізовані мід трьома ядрами атомів
кисню і вуглецю.
Все це робить карбоксилат-йон доволі стійким, тому карбонові кислоти – набагато сильніші кислоти ніж спирти.
Найсильна незаміщена карбонова кислота – метанова. Далі сила кислот поступово зменшується за рахунок прояву +І-ефекту алкільних груп, про що свідчать значення констант дисоціації (Кд).
|
|
|
|
Kд = 21,4 . 10-5 |
Kд = 1,76 .10-5 |
Kд = 1,50 .10-5 |
Kд = 155 . 10-5 |
Сила кислоти зростає, якщо до α-вуглецевого атома приєднана електроноакцепторна група, наприклад, атом галогену, або NO2-група.
При взаємодії з основами утворюються солі карбонових кислот:
![]()
2. Утворення галогенангідридів (ацилгалогенідів)
Галогенангідрид отримують шляхом заміни ОН-групи у карбоксильній групі на атом галогену, при дії на кислоти сильних галогенуючих агентів (РСІ3, PCI5, SOCI2 тощо):
![]()
Ацилхлорид
(хлорангідрид
карбонової кислоти)
Атом галогену в них дуже рухливий і легко вступає у реакцію заміщення зі сполуками, які містять атом металу або активний (рухливий) атом водню.
Через це хлорангідриди, являються активними ацилюючими агентами (вони вводять у молекули залишки кислот - ацили) і знаходять широке застосування в органічному синтезі. Реакція ацилювання відноситься до реакцій нуклеофільного заміщення (SN) в хлорангідриді.
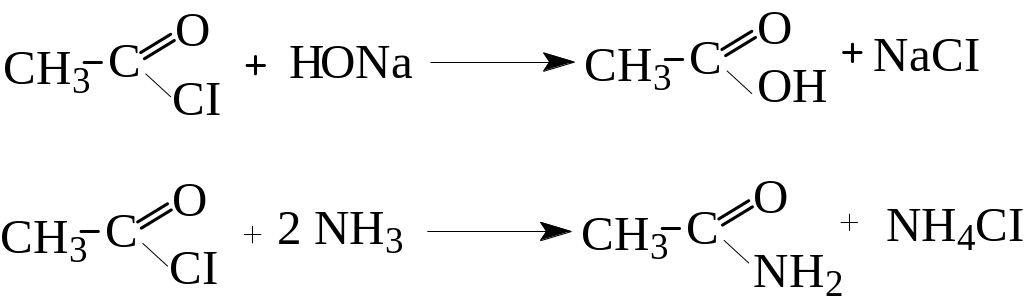
Ацетамід
(амід оцтової кислоти)
![]()
Етилацетат (естер)
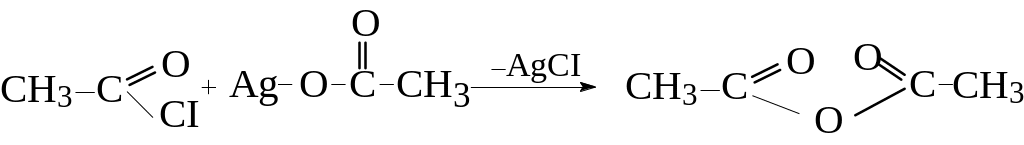
Оцтовий ангідрид
![]()
Натрій пероксид Пероксид ацетилу
Більшість таких реакцій відбувається за схемою:
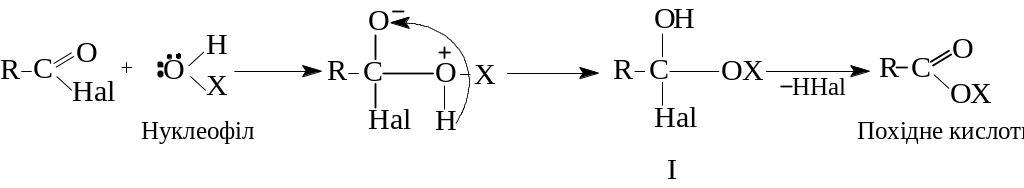
Нуклеофільний реагент (НОР) атакує позитивний атом вуглецю карбоксильної групи, а потім відбувається перехід водню до карбонільного кисню з утворенням проміжного нестійкого аддукту (І), який втрачає галогеноводень, перетворюючись на похідне кислоти.
3. Утворення ангідридів
Ангідриди кислот утворюються при відщепленні молекули води від двох молекул одноосновної кислоти
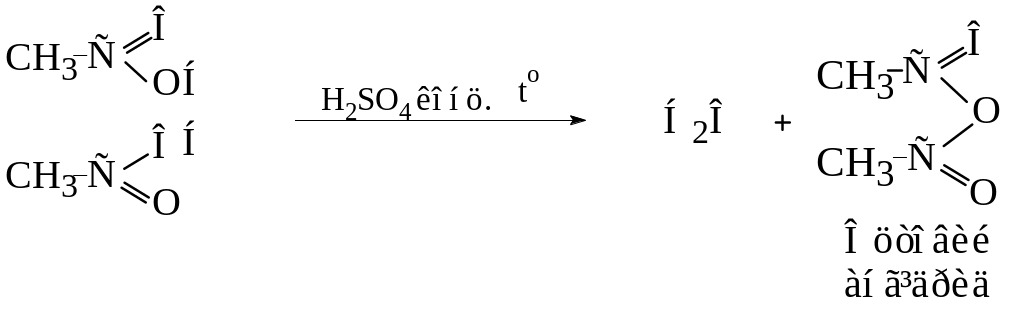
Другий метод (реакція ацилювання) наведений вище.
У промисловості оцтовий ангідрид отримують також через кетен (див.стор. ).
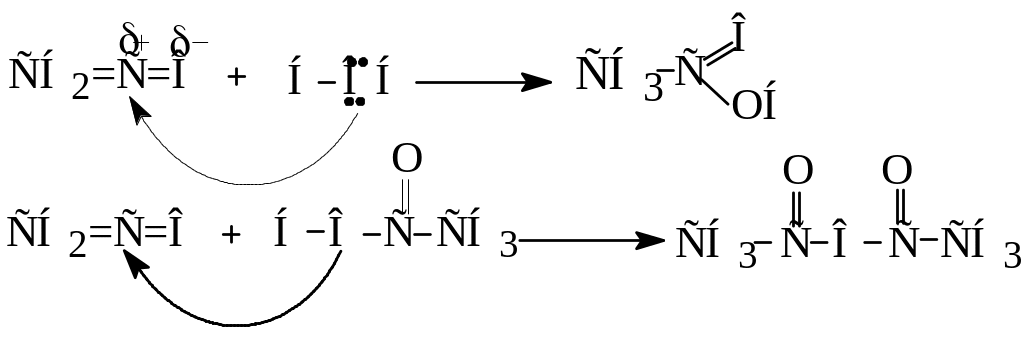
Ангідриди, подібно до хлорангідридів, є активними ацилюючими агентами і легко реагують з речовинами нуклеофільної природи:
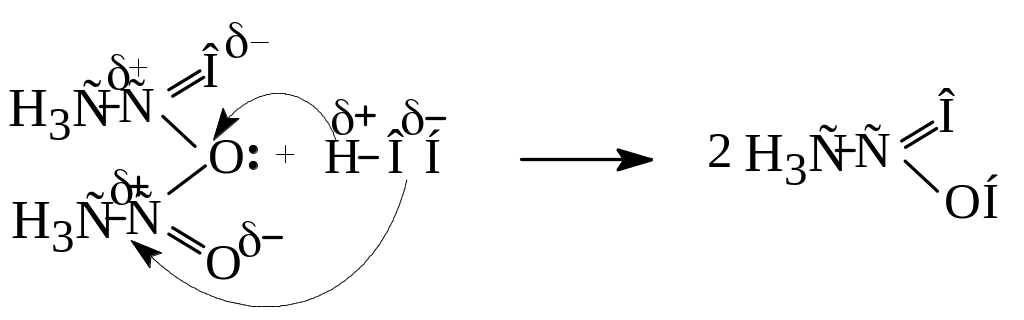
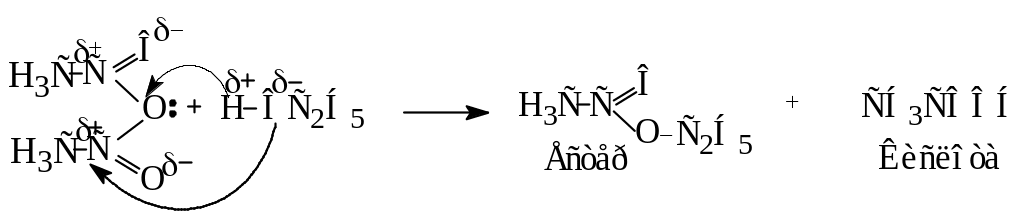
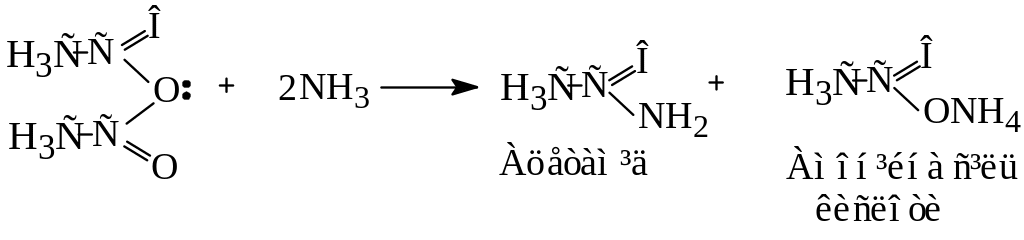
4. Утворення амідів
Аміди утворюються при взаємодії хлорангідридів або ангідридів кислот з аміаком:
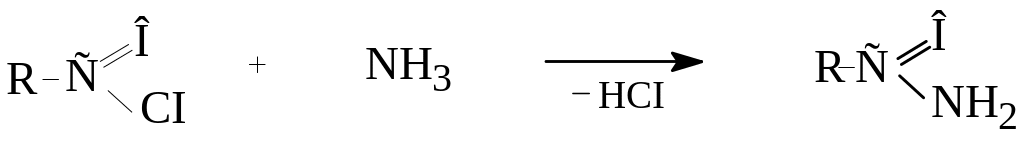
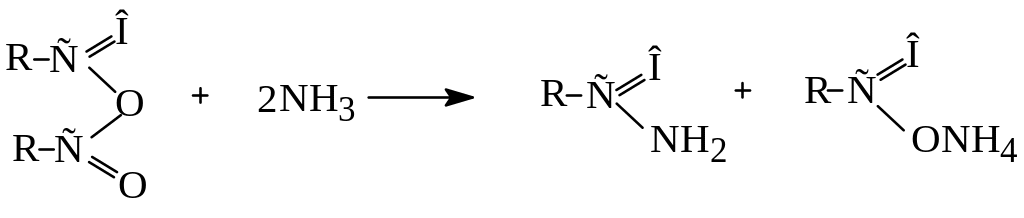
За іншим методом амід одержують дегідратацією при нагріванні амонійної солі:
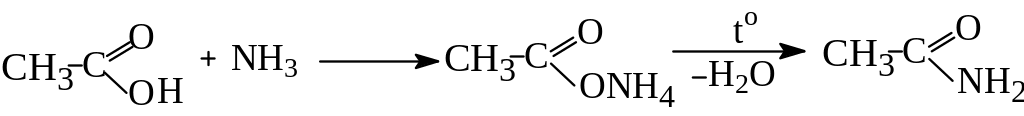
Ацетамід
Для цього суміш парів кислоти і аміаку пропускають над дегідратуючим каталізатором:
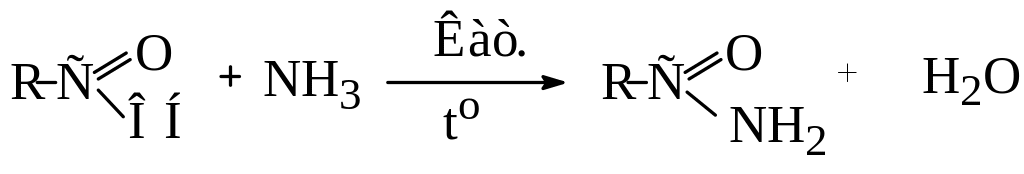
Аміди є також проміжними продуктами при гідролізі нітрилів:
Х![]() імічні
властивості амідів зумовлені наявністю
двох функціональних груп -NH2
і . При цьому має
місце p-π-спряження
між неподіленою електронною парою атома
азоту і π-зв'язком
карбонільної
групи.
Це викликає
зміщення p-електронів атома азоту до
карбонільної
групи
імічні
властивості амідів зумовлені наявністю
двох функціональних груп -NH2
і . При цьому має
місце p-π-спряження
між неподіленою електронною парою атома
азоту і π-зв'язком
карбонільної
групи.
Це викликає
зміщення p-електронів атома азоту до
карбонільної
групи
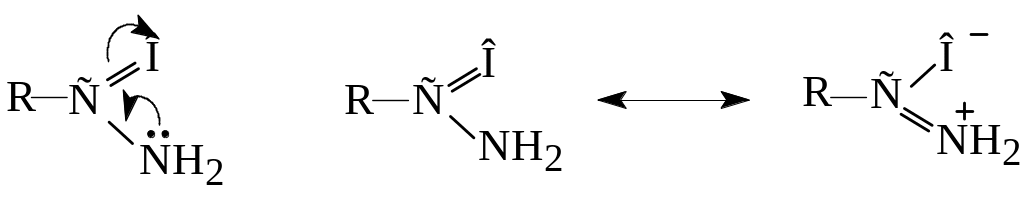
Внаслідок цього електронна густина на атомі азоту зменшується. Тому, аміди є дуже слабкими основами і утворюють солі тільки з сильними мінеральними кислотами, причому, приєднання протону протікає переважно до кисню С═О-групи:
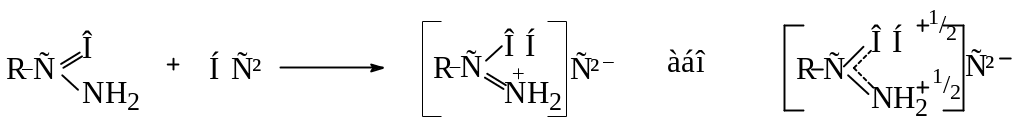
Одночасно аміди проявляють слабкі кислотні властивості і реагують з металічним натрієм з утворенням солей:
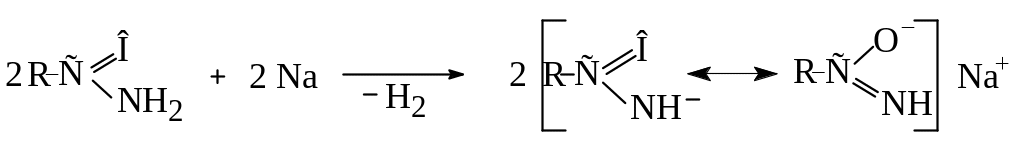
Отже, для амідів можлива внутрішньомолекулярна амідно-імідна таутомерія, де амідна форма енергетично вигідніша:
![]()
Амідна форма Імідна форма
Нарешті, здатність атома вуглецю карбонільної групи до взаємодії з нуклеофільними реагентами різко зменшується, внаслідок вищезгаданого p-π-спряження, тому аміди є дуже слабкими ацилюючими агентами.
