
Тема концентрация растворов
Дайте определения молярной концентрации раствора и запишите формулу для ее расчета, укажите единицы измерения.
Дайте определения моляльной концентрации раствора и запишите формулу для ее расчета, укажите единицы измерения.
Дайте определения эквивалентной (нормальной) концентрации раствора и запишите формулу для ее расчета, укажите единицы измерения.
Дайте определения массовой доли растворенного вещества и запишите формулу для ее расчета, укажите единицы измерения.
Дайте определения мольной доли растворенного вещества и запишите формулу для ее расчета, укажите единицы измерения.
Тема электролиз, окислительно-восстановительные реакции, гальванические элементы.
Составить уравнение процессов, протекающих при электролизе расплава:
![]() с инертными
электродами.
с инертными
электродами.
Составить схему электролиза водного раствора:
![]() ,
КОН,
,
КОН,
![]() ,
,
![]() ,
,
![]() ,
,
![]() с
платиновыми электродами.
с
платиновыми электродами.
Составить схемы электролиза водного раствора:
– сульфата меди, если: а) анод медный; б) анод угольный.
–нитрата серебра, если: а) анод серебряный; б) анод угольный.
– хлорида меди, если: а) анод медный; б) анод угольный.
– хлорида железа, если: а) анод железный; б) анод угольный.
– сульфата никеля, если: а) анод из никеля; б) анод угольный.
Подберите коэффициенты в схемах следующих окислительно-восстановительных реакций методом электронного баланса:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Ток силой 2,5 А выделил в течение 15 мин 0,72 г меди из раствора
 .
Вычислить коэффициент полезного
действия тока.
.
Вычислить коэффициент полезного
действия тока.Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А?
При электролизе водного раствора
 на аноде выделилось 3,8 л кислорода,
измеренного при 27°С и 100 кПа. Сколько
граммов
на аноде выделилось 3,8 л кислорода,
измеренного при 27°С и 100 кПа. Сколько
граммов
 выделилось на катоде?
выделилось на катоде?За 10 мин из раствора платиновой соли ток силой 5 А выделил 1,517 г
 .
Определить эквивалентную массу платины.
.
Определить эквивалентную массу платины.Для выделения 1,75 г некоторого металла из раствора его соли потребовалось пропускать ток силой 1,8 А в течение 1,5 ч. Вычислить эквивалент металла.
При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла.
При электролизе водного раствора сульфата никеля (II) на катоде получили никель массой 177 г, выход которого составил 75%. Какой объем кислорода выделится при этом на аноде? Выход кислорода считать количественным.
При электролизе водного раствора
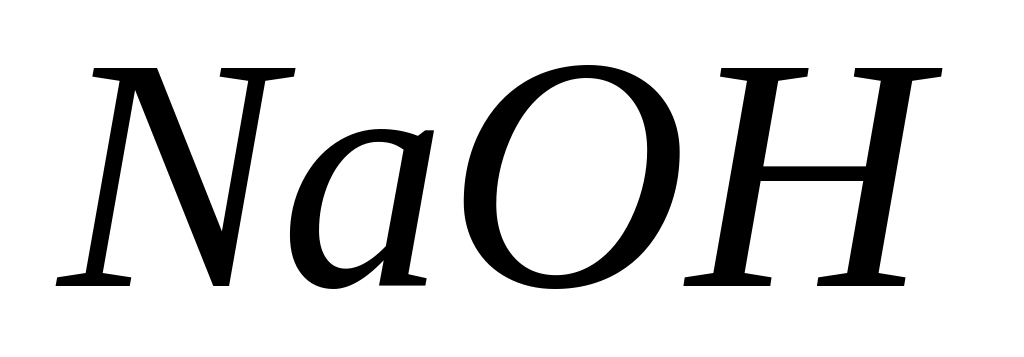 на аноде выделилось 5,8 л кислорода
(условия нормальные). Сколько водорода
выделилось на катоде?
на аноде выделилось 5,8 л кислорода
(условия нормальные). Сколько водорода
выделилось на катоде?При электролизе водного раствора хлорида цинка на аноде выделился хлор объемом 26,88 л (нормальные условия), а на катоде – цинк массой 62,4 г. Считая выход хлора количественным, определите выход цинка.
При электролизе водного раствора
 на аноде выделилось 2,8 л кислорода
(условия нормальные). Сколько водорода
выделилось на катоде?
на аноде выделилось 2,8 л кислорода
(условия нормальные). Сколько водорода
выделилось на катоде?При электролизе водного раствора гидроксида калия с инертными электродами на катоде выделился молекулярный водород, объем которого при нормальных условиях равен 11,2 л. Какой объем кислорода выделится при этом на аноде?
При электролизе раствора
 в течение 50 мин при силе тока 3 А на
катоде выделилось 9,6 г серебра. Определить
выход серебра в процентах от
теоретического.
в течение 50 мин при силе тока 3 А на
катоде выделилось 9,6 г серебра. Определить
выход серебра в процентах от
теоретического.При электролизе водного раствора на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде?
Один из способов промышленного получения кальция - электролиз расплавленного хлорида кальция. Какая масса металла будет получена, если известно, что в результате электролиза выделился хлор объемом 896 л (нормальные условия)?
При электролизе воды на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде?
При электролизе расплава хлорида калия на катоде получили калий массой 7,8 г. Определите объем хлора, который выделился на аноде. Объем рассчитайте при нормальных условиях.
При электролизе водного раствора
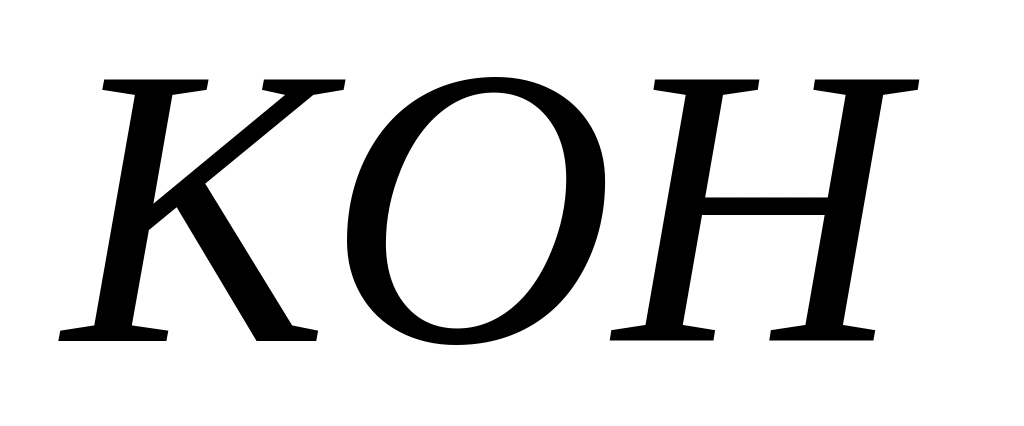 на аноде выделилось 2,8 л кислорода
(условия нормальные). Сколько водорода
выделилось на катоде?
на аноде выделилось 2,8 л кислорода
(условия нормальные). Сколько водорода
выделилось на катоде?Какая масса натрия выделится на катоде при электролизе расплава иодида натрия, если на аноде выделился иод массой 762 г?
При электролизе растворов на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
Ток силой 2,5 А выделил в течение 15 мин 0,72 г меди из раствора . Вычислить коэффициент полезного действия тока.
При электролизе водного раствора на аноде выделилось 3,8 л кислорода, измеренного при 27°С и 100 кПа. Сколько граммов выделилось на катоде?
При электролизе раствора в течение 50 мин при силе тока 3 А на катоде выделилось 9,6 г серебра. Определить выход серебра в процентах от теоретического.
Гальванический элемент состоит из:
– металлического цинка, погруженного в 0,3М раствор нитрата цинка, и металлического олова, погруженного в 0,05М раствор нитрата олова.
– металлического алюминия, погруженного в 0,1М раствор нитрата алюминия, и металлического олова, погруженного в 0,04М раствор нитрата олова
– металлического цинка, погруженного в 0,5М раствор нитрата цинка, и металлического олова, погруженного в 0,25М раствор нитрата олова.
– металлического железа, погруженного в 0,1М раствор нитрата железа, и металлического никеля, погруженного в 0,02М раствор нитрата никеля.
– металлического железа, погруженного в 0,3М раствор нитрата железа, и металлического никеля, погруженного в 0,15М раствор нитрата никеля.
– металлического железа, погруженного в 0,4М раствор нитрата железа, и металлического серебра, погруженного в 0,02М раствор нитрата серебра.
– металлического железа, погруженного в 0,1М раствор нитрата железа, и металлического серебра, погруженного в 0,04М раствор нитрата серебра.
– металлического железа, погруженного в 0,2М раствор нитрата железа, и металлического серебра, погруженного в 0,2М раствор нитрата серебра.
– металлического кобальта, погруженного в 0,4М раствор нитрата кобальта, и металлической меди, погруженной в 0,02М раствор нитрата меди.
– металлического цинка, погруженного в 0,1М раствор нитрата цинка, и металлического олова, погруженного в 0,02М раствор нитрата олова.
– металлического цинка, погруженного в 0,3М раствор нитрата цинка, и металлического олова, погруженного в 0,05М раствор нитрата олова.
Вычислить ЭДС элемента, написать уравнения электродных процессов и окислительно-восстановительной реакции, протекающей в данном гальваническом элементе, составить схему элемента.
