
- •Механическое движение, его виды. Материальная точка. Абсолютно твердое тело. Путь, перемещение, скорость, ускорение материальной точки.
- •Явление вязкого трения. Коэффициент вязкости.
- •Описание движения материальной точки в декартовой системе координат. Радиус- вектор материальной точки. Траектория, путь и перемещение.
- •Явление теплопроводности. Коэффициент теплопроводности.
- •2. Явление диффузии. Коэффициент диффузии.
- •Понятие о длине свободного пробега. Эффективный диаметр. Среднее число столкновений и средняя длина свободного пробега молекул.
- •Первый закон Ньютона. Инерциальные системы отсчета. Сила. Принцип суперпозиции сил.
- •2. Круговой процесс (цикл). Тепловые двигатели и холодильные машины. Кпд цикла. Цикл Карно и его кпд для идеального газа. Диаграмма. Круговой процесс
- •1. Масса и импульс тела. Второй и третий законы Ньютона.
- •Расчет изменения энтропии для различных процессов
- •Абсолютная энтропия
- •Классификация сил в механике. Сила гравитационного притяжения. Сила тяжести и вес тела. Сила упругости. Силы трения.
- •Сила трения[править | править вики-текст]
- •Второе начало термодинамики. Энтропия термодинамической системы. Свойства энтропии. Теорема Нернста. Статистическое толкование энтропии.
- •6 Энтропия
- •§7 Второе начало термодинамики
- •1. Замкнутые механические системы. Импульс системы тел. Закон движения центра масс.
- •2. Понятие адиабатного процесса. Уравнение Пуассона. Показатель адиабаты идеального газа.
- •Адиабата Пуассона[
- •Вывод уравнения[править | править вики-текст]
- •1. Момент силы относительно точки и относительно оси. Момент импульса относительно точки и оси. Уравнение моментов. Закон сохранения момента импульса.
- •Закон сохранения момента импульса
- •Применение первого начала термодинамики к различным изопроцессам в идеальном газе.
2. Понятие адиабатного процесса. Уравнение Пуассона. Показатель адиабаты идеального газа.
АДИАБАТНЫЙ ПРОЦЕСС
Адиабатный процесс — процесс, при котором отсутствует теплообмен между системой и окружающей средой.
Из
первого начала термодинамики следует,
что работа газа при адиабатном процессе
совершается за счет его внутренней
энергии:
![]() (1).
С
другой стороны, из уравнения
Клапейрона-Менделеева следует:
(1).
С
другой стороны, из уравнения
Клапейрона-Менделеева следует:
![]() (2).
Разделим
уравнение (2) на уравнение (1):
(2).
Разделим
уравнение (2) на уравнение (1):
![]() ,
где
,
где
![]() .
Проинтегрируем
полученное уравнение:
.
Проинтегрируем
полученное уравнение:
![]() .
Таким
образом, при адиабатном процессе
.
Таким
образом, при адиабатном процессе
![]() или
или ![]() —
уравнение Пуассона.
С учетом уравнения
Клапейрона-Менделеева (
—
уравнение Пуассона.
С учетом уравнения
Клапейрона-Менделеева (![]() ,
,![]() )
уравнение
Пуассона может быть представлено в
виде:
)
уравнение
Пуассона может быть представлено в
виде:
![]() или
или ![]()
![]() или
или ![]() .
.
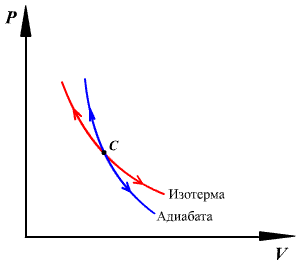 График
адиабатного процесса — более крутая
кривая, чем гипербола при изотермическом
процессе. Это следует из выражения
производной
График
адиабатного процесса — более крутая
кривая, чем гипербола при изотермическом
процессе. Это следует из выражения
производной ![]() ,
полученной из уравнения Пуассона.
,
полученной из уравнения Пуассона.
Работа
газа при адиабатном процессе равна
убыли внутренней энергии:
![]() .
.
Адиабати́ческий,
или адиаба́тный
проце́сс (от др.-греч. ἀδιάβατος —
«непроходимый») — термодинамический
процесс в
макроскопической системе, при котором
система не обменивается теплотой с
окружающим пространством.
![]() Серьёзное
исследование адиабатических процессов
началось в XVIII веке[1].
Серьёзное
исследование адиабатических процессов
началось в XVIII веке[1].
Адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянна[2]. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётсяравновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только обратимые адиабатические процессы[3].
Адиабата Пуассона[
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[6][15][16]
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.

График
адиабаты (жирная линия) на ![]() диаграмме
для газа.
диаграмме
для газа.
![]() —
давление газа;
—
объём.
—
давление газа;
—
объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где — абсолютная температура газа. Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
)
газ нагревается (
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
)
газ нагревается (
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
Вывод уравнения[править | править вики-текст]
Согласно закону Менделеева — Клапейрона[6] для идеального газа справедливо соотношение
![]()
где
R — универсальная
газовая постоянная.
Вычисляя полные дифференциалы от обеих
частей уравнения, полагая
независимыми термодинамическими
переменными ![]() ,
получаем
,
получаем
-

(3)
Если
в (3) подставить ![]() из (2),
а затем
из (2),
а затем ![]() из (1),
получим
из (1),
получим
![]()
или,
введя коэффициент ![]() :
:
![]() .
.
Это уравнение можно переписать в виде
![]()
что после интегрирования даёт:
![]() .
.
Потенцируя, получаем окончательно:
![]()
что и является уравнением адиабатического процесса для идеального газа.
Показатель
адиабаты (иногда
называемый коэффициентом Пуассона) —
отношение теплоёмкости при
постоянном давлении (![]() )
к теплоёмкости при постоянном объёме
(
).
Иногда его ещё
называют фактором изоэнтропийного расширения.
Обозначается греческой буквой
)
к теплоёмкости при постоянном объёме
(
).
Иногда его ещё
называют фактором изоэнтропийного расширения.
Обозначается греческой буквой ![]() (гамма)
или
(гамма)
или ![]() (каппа).
Буквенный символ в основном используется
в химических инженерных дисциплинах.
В теплотехнике используется латинская буква
[1].
(каппа).
Буквенный символ в основном используется
в химических инженерных дисциплинах.
В теплотехнике используется латинская буква
[1].
Уравнение:
![]() ,
,
где
![]() — теплоёмкость газа,
— теплоёмкость газа,
![]() — удельная
теплоёмкость (отношение
теплоёмкости к единице массы) газа,
— удельная
теплоёмкость (отношение
теплоёмкости к единице массы) газа,
индексы ![]() и
и ![]() обозначают
условие постоянства давления или
постоянства объёма, соответственно.
обозначают
условие постоянства давления или
постоянства объёма, соответственно.
БИЛЕТ 9
