
- •Введение
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •Учебно-целевые вопросы.
- •Задачи.
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература.
- •III. Исходный уровень:
- •IV. Содержание занятия.
- •Учебно-целевые вопросы.
- •Задачи.
- •3. Лабораторные работы.
- •Аналитические реакции катионов шестой группы по кислотно-основной классификации
- •4. Тест-контроль 1 по теме: «Аналитические реакции первой, второй, третьей групп». Примерный вариант.
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •3. Контрольная работа по темам занятий 1-2. Вариант контрольной работы.
- •V. Литература.
- •III. Исходный уровень.
- •3. Лабораторная работа. Разделение и идентификация катионов IV, V, VI групп:
- •Анализ смеси катионов IV, V, VI аналитических групп
- •4. Тест-контроль 2 по темам: «Аналитические реакции катионов четвертой, пятой, шестой групп». Примерный вариант.
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •Учебно - целевые вопросы.
- •Лабораторные работы.
- •3.1. Реакции обнаружения
- •3.Аналитические реакции анионов первой группы.
- •3.1. Реакции обнаружения анионов первой группы
- •Аналитические реакции сульфит-иона so32-.
- •Аналитические реакции тиосульфат-иона s2o32-
- •Аналитические реакции анионов третьей группы
- •V. Литература.
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •4. Контрольная работа №2. Вариант контроля.
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература.
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •1. Анализ сухой соли. Качественное определение катионов и анионов (занятие 1)
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •3. Лабораторная работа.
- •V. Литература.
- •III. Исходный уровень:
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература.
- •Тема: Титриметрический анализ. Кислотно - основное титрование. Приготовление и стандартизация титранта.
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •Учебно - целевые вопросы
- •Задания для выполнения в процессе самоподготовки
- •V. Литература для самоподготовки студента.
- •Тема: Кислотно - основное титрование. Определение масс двух
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •Учебно - целевые вопросы
- •Задания для выполнения в процессе самоподготовки
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература для самоподготовки студента.
- •I. Тема: Окислительно–восстановительное титрование.
- •II. Мотивация цели:
- •III. Исходный уровень.
- •IV. Содержание занятия:
- •Учебно - целевые вопросы
- •Задания для выполнения в процессе самоподготовки
- •3.1. Стандартизация раствора перманганата калия по оксалату натрия
- •V. Литература для самоподготовки студента.
- •I. Тема: Окислительно - восстановительное титрование.
- •II. Мотивация цели:
- •III. Исходный уровень:
- •IV. Содержание занятия.
- •Учебно - целевые вопросы
- •Задания для выполнения в процессе самоподготовки
- •V. Литература для самоподготовки студента.
- •I. Тема: Окислительно - восстановительное титрование.
- •II. Мотивация цели:
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •Учебно - целевые вопросы
- •Задания для выполнения в процессе самоподготовки
- •V. Литература для самоподготовки студента
- •I. Тема: Окислительно - восстановительное титрование.
- •II. Мотивация цели:
- •III. Исходный уровень:
- •IV. Содержание занятия.
- •3. Вариант текущего контроля по теме: «Окислительно-восстановительное титрование».
- •V. Литература для самоподготовки студента.
- •I. Тема: Окислительно - восстановительное титрование.
- •III Исходный уровень
- •IV. Содержание занятия.
- •3. Контрольная работа по темам: «Кислотно-основное титрование. Окислительно-восстановительное титрование. Перманганатометрия. Иодометрия. Хлориодометрия. Дихроматометрия».
- •V. Литература для самоподготовки студента.
- •I. Тема: Комплексиметрическое титрование.
- •II. Мотивация цели:
- •III Исходный уровень
- •IV. Содержание занятия.
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •3Контрольная работа по темам: «Броматометрия. Нитритометрия. Цериметрия. Комплексонометрия.»
- •V. Литература для самоподготовки студента.
- •I. Тема: Осадительное титрование.
- •III. Исходный уровень:
- •Задания для выполнения в процессе самоподготовки
- •Вопросы самостоятельной работы
- •V. Литература для самоподготовки студента.
- •Тема: Оптические методы анализа:
- •III Исходный уровень:
- •VI. Содержание занятия.
- •Задания для выполнения в процессе самоподготовки
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература для самоподготовки студента.
- •I. Тема: Флуориметрия.
- •II. Мотивация цели:
- •III. Исходный уровень
- •IV. Содержание занятия.
- •Задания для выполнения в процессе самоподготовки
- •Контрольная работа № 3 по темам: ,,Осадительное титрование. Фотоэлектроколориметрия. Спектрофотометрия. Флуориметрия.”
- •V. Литература для самоподготовки студента.
- •II. Тема: Хроматографические методы анализа.
- •II. Мотивация цели:
- •III. Исходный уровень:
- •IV. Содержание занятия.
- •Задания для выполнения в процессе самоподготовки
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература для самоподготовки студента.
- •I. Тема: Электрохимические методы анализа.
- •III. Исходный уровень.
- •IV. Содержание занятия.
- •Задания для выполнения в процессе самоподготовки
- •Вопросы самостоятельной работы
- •Задачи самостоятельной работы
- •V. Литература для самоподготовки студента.
- •I. Тема: Электрохимические методы анализа.
- •II. Мотивация цели:
- •III. Исходный уровень:
- •IV. Содержание занятия.
- •Вопросы самостоятельной работы
- •Задания для выполнения в процессе самоподготовки
- •V. Литература для самоподготовки студента.
- •Приложение
- •1. Схема математической обработки результатов анализа Исключение грубых промахов
- •III. Литература.
- •Вопросы контрольной работы по аналитической химии для студентов фармацевтического факультета
Задачи.
2.9. Рассчитайте произведение растворимости хлорида серебра АgСl, если молярная концентрация его насыщенного раствора равна S = 1,33·10-5 моль/дм³.
2.10. Рассчитайте молярную концентрацию катионов свинца [Рb2+] и иодид-ионов [I-] в насыщенном водном растворе иодида свинца PbI2, если его произведение растворимости ПР(РbI2) = 1,1·10-9.
2.11. Как изменится молярная растворимость иодида серебра, если к его насыщенному раствору прибавить иодид калия до концентрации C(KI) =1,0·10-4 моль/дм³? Произведение растворимости иодида серебра ПР (AgI)= 8,3·10-17.
2.12. Как изменится растворимость оксалата кальция при добавлении в его насыщенный водный раствор хлорида калия КС1 до концентрации С(КС1) = 0,10 моль/дм³? Произведение растворимости оксалата кальция равно ПР (СаС2О4) = 2,3·10-9.
2.13. В водном растворе присутствуют сульфат-ион SO4-2 и оксалат ион С2О42- в одинаковых концентрациях. К этому раствору медленно приливают водный раствор хлорида кальция СаСl2. В какой последовательности будут осаждаться из раствора сульфат – ион и оксалат - ион? Произведения растворимости этих солей равны ПР(СаС 2О4) = 2,3·10-9 и ПР (Са SO4) = 2,5·10-5.
2.14. В систему состоящую из осадка хромата бария ВаСrО4 и его насыщенного водного раствора, вводят карбонат натрия Nа2СО3. При каком соотношении концентраций карбонат-ионов и хромат-ионов [СО32-] и [СrО42-] осадок превращается в осадок карбоната бария ВаСО3 по реакции:
BaCrO4 (т) + CO32- → BaCO3↓ + CrO42-
Произведения растворимости равны: ПР (ВаСrО4) = 1,2·10-10;
ПР (ВаСО3) = 4,0·10-10.
3. Лабораторные работы.
Аналитические реакции катионов четвертой и пятой групп по кислотно-основной классификации: Zn (II) , Al (III) , Sn (II, IV), As (III, V), Cr (III),
Sb (III, V), Bi (III), Mn (II), Fe (II, III), Мg(II).
Обнаружение катионов четвертой группы.
Аналитические реакции катионов цинка Zn (II).
а) Реакция с тетрароданомеркуратом (II) аммония образует с ионами цинка в слабокислой среде белый кристаллический осадок Zn[Hg(SCN)4]:
Zn2+ + [Hg(SCN)4]2- → Zn[Hg(SCN)4]↓
Осадок растворяется в сильных кислотах и разлагается щелочами с образованием желтого осадка HgО. Предел обнаружения цинка – 30 мкг. В присутствии Сu2+ образуются изоморфные кристаллы фиолетового цвета; в присутствии Со2+ - от голубого до синего цвета в зависимости от концентрации ионов кобальта.
Выполнение реакции. К 2-3 каплям раствора, содержащего ионы цинка, добавляют каплю разбавленного раствора соли кобальта и 2-3 капли реагента. Слегка потирают палочкой по стенкам пробирки. В присутствии цинка образуется голубой осадок. Рекомендуется провести контрольный опыт. Для приготовления разбавленного раствора соли кобальта в пробирку помещают 1-2 капли 0,1 моль/дм³ раствора кобальта и разбавляют дистиллированной водой (3-5 см³).
б) Реакция с дитизоном (дивинилтиокарбазоном). В пробирку вносят 5-10 капель раствора ZnCl2, прибавляют несколько капель раствора гидроксида натрия до растворения выпавшего белого осадка гидроксида цинка и 5 капель хлороформного раствора дитизона, встряхивают. Раствор окрашивается в красный цвет.
Выполнение реакции. В пробирку вносят 5-10 капель раствора ZnCl2, прибавляют постепенно несколько капель раствора NaOH до растворения выпавшего белого осадка гидроксида цинка и ~5 капель хлороформного раствора дитизона. Пробирку встряхивают несколько раз. После расслоения смеси хлороформный слой окрашивается в красный цвет.
в) Реакция с сероводородом или сульфидом аммония. Поместите в пробирку 3-5 капель раствора какой-либо соли цинка, добавьте несколько капель предварительно нейтрализованной формиатной буферной смеси (вместо формиатной буферной смеси можно добавить 0,05 моль/дм³ раствор НCl – ¼ от объема раствора) и пропустите через раствор сероводород или свежеприготовленный сульфид аммония. Выпадает белый осадок сульфида цинка:
Zn 2+ + S 2- → ZnS↓
Эта реакция имеет большое значение. Ее применяют не только для обнаружения Zn2+, но и для отделения его (при рН 2) от Ni2+, Co2+, Fe2+, Mn2+ и некоторых других. Для осаждения ZnS в присутствии Ni2+ и Co2+ можно применять ацетатную буферную систему.
Выполнение реакции. 1. Осаждение может быть выполнено в широком интервале значений рН: от 2 до 9.
2. Осаждение лучше проводить при нагревании в ацетатном или формиатном буферном растворе; при этом осадок получается крупнозернистый, легко отделяющийся фильтрованием и промывающийся.
3. Не рекомендуется осаждать ZnS из аммиачных растворов, содержащих [Zn(NH3)6]2+, так как образующийся при этом сульфид получается в коллоидном состоянии.
4. Катионы, образующие в тех же условиях осадки с сульфид-ионами, должны быть предварительно удалены.
5. В присутствии окислителей, окисляющих S2-, образуется осадок серы, который может быть принят за осадок ZnS. Поэтому осаждение сероводородом необходимо проводить в отсутствие окислителей.
г) Реакция с гексацианоферратом (II) калия K4[Fe(CN)6]. Поместите в пробирку 2-3 капли раствора какой-либо соли цинка, прибавьте 3 капли раствора K4[Fe(CN)6] и нагрейте смесь до кипения. При этом образуется белый осадок:
3Zn2+ + 2K+ + [Fe(CN)6]4- → K2Zn3[Fe(CN)6]↓
Выполнение реакции. 1. Значение рН 7, так как осадок в щелочной среде растворяется.
2. При действии избытка реактива может получиться более растворимый осадок Zn2[Fe(CN)6].
3. Ионы алюминия и хрома не мешают этой реакции, другие катионы третьей аналитической группы должны быть удалены.
4. Окислители, окисляющие К4[Fe(CN)6] в К3[Fe(CN)6], должны отсутствовать.
д) Реакция с гидроксидом натрия NaOH и аммиаком NH3. При осторожном прибавлении по каплям щелочей или аммиака выделяется белый осадок гидроксида цинка:
Zn2+ + 2OH- → Zn(OH)2↓
Он растворим как в кислотах, так и в щелочах, так как гидроксид цинка амфотерен:
Zn(OH)2↓+ 2H+ → Zn2+ + 2H2O
Zn(OH)2↓ + 2OH- → [Zn(OH)4]2-
Zn(OH)2↓ + 6NH4+ → [Zn(NH3)6]2+ + 2H2O + 4H+
Выполнение реакции. В пробирку вносят 5-6 капель раствора хлорида цинка, прибавляют 1-2 капли раствора NaOH. Выпадает белый осадок гидроксида цинка. Продолжают прибавлять по каплям раствор NaOH при перемешивании содержимого пробирки. Осадок растворяется.
е) Реакция с нитратом кобальта Со(NО3)2.
Выполнение реакции 1. При нагревании оксида цинка с небольшим количеством нитрата кобальта Со(NО3)2 образуется цинкат кобальта, так называемая зелень Ринмана:
2ZnO + 2Co(NO3)2 → 2CoZnO2↓ + 4NO2↑ + O2↑
Выполнение реакции 2. Осадок Zn(ОН)2 или Zn(NО3)2 помещают на крышке микротигля на полоску фильтровальной бумаги, смоченной предварительно каплей раствора Со(NО3)2 и осторожно нагревают до озоления. Получается зеленая зола вследствие образования зелени Ринмана.
Аналитические реакции катионов алюминия Al (III).
а) Реакция с гидроксидом натрия NaOH. В пробирку вносят 3-5 капель раствора хлорида алюминия и прибавляют по каплям раствор гидроксида натрия. Выпадает белый осадок гидроксида алюминия. Продолжают прибавлять щелочь, осадок растворяется. К раствору прибавляют несколько кристаллов хлорида аммония и нагревают смесь. Выпадает осадок гидроксида алюминия, растворяющийся в щелочах и кислотах:
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3↓+ 3OH- → [Al(OH)3]3-
Al(OH)3↓+ 3H+- → Al3+ + 3H2O
Если к комплексной соли добавить твердый NH4Сl, то вновь образуется осадок гидроксида алюминия.
[Al(OH)6]3- + 3NH4+ → Al(OH)3↓+ NH3↑ + 3H2O
Катионы алюминия образуют с аммиаком также белый аморфный осадок гидроксида алюминия, который не растворяется в избытке раствора аммиака, в отличие от действия щелочей.
Выполнение реакции. В пробирку вносят 3-5 капель раствора хлорида алюминия и прибавляют по каплям раствор NaOH. Выпадает белый осадок гидроксида алюминия. Продолжают прибавление по каплям раствора NaOH. Осадок растворяется.
б) Реакция с аммиаком. Катионы AI3+ образуют с аммиаком, как и с щелочами, белый аморфный осадок гидроксида алюминия:
Al3++ 3NH3∙H2O → Al(OH)3 ↓+3NH4+
В избытке раствора аммиака осадок не растворяется, в отличие от действия щелочей.
в) Реакция с
нитратом кобальта – образование
«тенаровой сини» (фармакопейная). При
прокаливании соли алюминия, смоченной
разбавленным раствором нитрата кобальта
![]() ,
образуется смешанный оксид алюминия и
кобальта (алюминат кобальта) синего
цвета – так называемая «тенаровая
синь»:
,
образуется смешанный оксид алюминия и
кобальта (алюминат кобальта) синего
цвета – так называемая «тенаровая
синь»:
2Al2(SO4)3 + 2Co(NO3)2 → 2Co(AlO2)2 + 4NO2 ↑+ 6SO3 ↑+ O2↑
Выполнение реакции. Полоску фильтрованной бумаги смачивают вначале 1-2 каплями раствора сульфата алюминия, а затем 1-2 каплями разбавленного раствора нитрата кобальта. Бумагу высушивают, помещают в фарфоровый тигель и озоляют на газовой горелке. Получают золу синего цвета – «тенаровую синь».
г) Реакция с алюминоном. В пробирку вносят 3-4 капли раствора соли алюминия, 2-3 капли раствора уксусной кислоты и 3-5 капель 0,01% раствора алюминона. Смесь нагревают на водяной бане, прибавляют несколько капель раствора аммиака до щелочной реакции (по лакмусовой бумажке) и 2-3 капли раствора карбоната аммония. Выпадает красный хлопьевидный осадок алюминиевого лака.
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли алюминия, 2-3 капли раствора уксусной кислоты и 4-5 капель 0,01%-го раствора алюминона. Смесь нагревают на водяной бане, прибавляют несколько капель раствора аммиака до щелочной реакции (по лакмусовой бумаге) и 2-3 капли раствора карбоната аммония. Выпадает красный хлопьевидный осадок.
д) Реакция с ализариновым красным. На лист фильтровальной бумаги наносят 1-2 капли раствора соли алюминия. Бумагу держат 1-2 минуты в парах аммиака. Пары аммиака, соприкасаясь с влажным пятном, образуют на бумаге гидроксид алюминия. На пятно наносят каплю раствора ализарина и снова держат бумагу в парах аммиака. Пятно вначале окрашивается в фиолетовый цвет. Бумагу подсушивают, наносят на нее 1-2 капли раствора уксусной кислоты и снова высушивают. Пятно становится розово-красным.
Выполнение реакции. На лист фильтрованной бумаги наносят 1-2 капли раствора соли алюминия. Бумагу держат 1-2 мин в парах аммиака – над склянкой с концентрированным раствором аммиака. Пары аммиака, соприкасаясь с влажным пятном, образуют на бумаге гидроксид алюминия.
На пятно наносят каплю раствора ализарина и снова держат бумагу в парах аммиака. Пятно вначале окрашивается в фиолетовый цвет (цвет фона ализарина). Бумагу подсушивают, наносят на нее 1-2 капли раствора уксусной кислоты и снова высушивают. Пятно становится розово-красным.
е) Реакция с 8-оксихинолином. 8-Оксихинолин образует с алюминием при рН = 4,5 - 10 внутрикомплексное соединение (С9Н6NО)3Al. Оксихинолинат Al малорастворим в воде, хорошо экстрагируется органическими растворителями (СНСl3 , ССl4, спиртами, кетонами). Экстракты окрашены в желтый цвет и интенсивно флуоресцируют зеленым светом. Al (III) можно отделить от большинства катионов экстракцией его оксихинолината при рН 9 в присутствии соответствующих маскирующих веществ (винная кислота, цианид калия, пероксид водорода и др.).
Выполнение реакции 1) На фильтровальную бумагу наносят каплю раствора, содержащего ионы алюминия, каплю ацетатного буферного раствора (рН = 6,5–9,5) и каплю 0,03 %-ого этанольного раствора оксихинолина. В присутствии алюминия влажное пятно в ультрафиолетовом свете имеет зеленое свечение.
2) В пробирку вводят 2-5 капель раствора соли алюминия, добавляют ацетатный буферный раствор до рН = 6,5 – 9, затем 5-6 капель 1 %-ого раствора оксихинолина в хлороформе и, закрыв пробирку пробкой, экстрагируют в течение 1-2 мин. Органическая фаза в присутствии алюминия окрашивается в желтый цвет. Для более четкого обнаружения алюминия можно добавить 1-2 капли ализарина, образуется ализариновый лак красного цвета. В ультрафиолетовом свете наблюдается зеленое свечение органической фазы.
Аналитические реакции катионов олова Sn (II).
а) Реакция с сероводородом H2S. К нескольким каплям раствора соли олова прибавляют несколько капель раствора H2S или (NH4)2S. Выпадает темно-бурый осадок сульфида олова:
Sn2+ + S2- → SnS↓
Выполнение реакции. К нескольким каплям раствора соли олова (II) прибавляют несколько капель раствора сульфида натрия (или же сульфида аммония, либо сероводородной воды). Выпадает бурый осадок сульфида олова (II).
б) Реакция с хлоридом ртути (II) HgCl2. К 3-5 каплям раствора соли олова прибавляют 2-3 капли раствора хлорида ртути. В присутствии олова вначале происходит восстановление ртути (II) до ртути (I) и выделяется белый осадок каломели Hg2Cl2, постепенно чернеющий вследствие образования тонкодисперстной металлической ртути и дальнейшем восстановлении ртути (I) оловом (II) до металлической ртути.
Выполнение реакции. В пробирку вносят 3-5 капель солянокислого раствора хлорида олова (II) и прибавляют 2-3 капли раствора хлорида ртути (II) – сулемы HgCl2. Выпадает белый осадок каломели Hg2Cl2, который постепенно чернеет за счет выделяющейся металлической ртути.
в) Реакция со щелочами. Соединения олова (II) при взаимодействии с щелочами выделяют из растворов белый осадок гидроксида олова (II) Sn(OH)2 , растворимый в избытке реагента с образованием гидроксокомплекса:
Sn2+ + 2OH- → Sn(OH)2↓
Sn(OH)2 ↓+ 2H2O → [Sn(OH)4]2- + 2H+
Осадок Sn (OH)2 растворяется в кислотах.
Выполнение реакции. В пробирку вносят несколько капель раствора соли олова (II) (обычно – солянокислого) и прибавляют по каплям раствор NaOH: вначале до выпадения белого осадка Sn(OH)2, а затем до его растворения.
г) Реакция с аммиаком. При прибавлении раствора аммиака к раствору, содержащему олова (II), выделяется белый осадок гидроксида олова Sn (OH)2, который не растворяется в избытке аммиака:
Sn2+ + 2NH3∙H2O → Sn(OH)2 ↓+ 2NH4+
Выполнение реакции. Проведения реакции аналогична предыдущей.
д) Реакция с солями висмута (III). Олово (II) является хорошим восстановителем. Так, при взаимодействии с висмутом (III) в щелочной среде оно восстанавливает висмут (III) до металлического висмута, само окисляясь до олова (IV):
2Bi3+ + 3 [Sn(OH)4]2- + 6OH- → 2Bi + 3[Sn(OH)6]2-
Металлический висмут, выделяясь в тонкодисперсном состоянии, образует осадок черного цвета.
Выполнение реакции. В пробирку вносят 3-5 капель раствора соли олова (II) и прибавляют по каплям раствор NaOH. Вначале выпадает белый осадок
Sn (OH)2 , который при дальнейшем прибавлении NaOH растворяется. К полученному щелочному раствору прибавляют 1-2 капли раствора нитрата висмута (III). При перемешивании смеси выпадает черный осадок металлического висмута.
Аналитические реакции катионов олова Sn (IV).
а) Восстановление олова (IV) до олова (II) металлами. Металлические Mg и Al могут восстанавливать Sn (IV) до металлического олова в слабокислой среде.
Выполнение реакции. К 2-3 каплям солянокислого раствора соли Sn (IV) добавляют железные опилки и нагревают до появления пузырьков. Затем раствор сливают в другую пробирку и добавляют 2 капли раствора Hg(NO3)2. выпадает белый осадок Hg2Cl2.
б) Хлориды цезия или рубидия (микрокристаллоскопическая реакция). При добавлении к раствору, содержащему ионы олова (IV), твердых RbCl или CsCl образуются блестящие прозрачные кристаллы Rb2SnCl6, Cs2SnCl6.
Выполнение реакции. На предметное стекло наносят 1 каплю раствора, содержащего ионы олова (IV), вносят кристаллик хлорида цезия или рубидия. Вокруг кристаллика появляется белое облачко осадка. Под микроскопом рассматривают мелкие кристаллы, имеющие форму октаэдров. Более крупные кристаллы образуются обычно у краев осадка.
в) Действие H2S или Na2S. Сульфид
Осадок растворим в избытке реактива с натрия выделяет из кислых растворов солей олова сульфид олова SnS2, ярко-желтого цвета, растворимый в концентрированной соляной кислоте, сульфиде аммония и избытке сульфида натрия.
Выполнение реакции. В пробирку вносят 3-4 капли солянокислого раствора соли олова (IV) и прибавляют по каплям сероводородную воду. Выпадает желтый осадок сульфида олова (IV).
При добавлении к смеси раствора сульфида натрия или аммония осадок растворяется.
г) Действие NaOH и KOH. Щелочи при осторожном прибавлении к раствору соли Sn (IV) выделяют белый студенистый осадок гидроксида олова (IV) или α-оловянной кислоты:
[SnCI6]2- + 4OH- → Sn(OH)4 ↓ + 6CI-
образованием станната и в кислой среде с образованием соответствующих солей:
Sn(OH)4 ↓ + 2OH- → [Sn(OH)6]2-
Sn(OH)4 ↓ + 4H+ + 6CI- → [SnCI6]2- + 4H2O
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли олова (IV) и по каплям прибавляют раствор NaOH. Вначале выпадает белый осадок, который растворяется при добавлении избытка раствора щелочи.
Аналитические реакции катионов мышьяка As (III) и мышьяка As (V). Мышьяк (III) и мышьяк (V)обычно открывают в виде арсенит-ионов AsO33- и арсенат-ионов AsO43- соответственно, т.е. в форме анионов, а не в форме катионов. Поэтому реакции этих анионов описаны далее в занятии, посвященной рассмотрению аналитических реакций анионов.
Обнаружение катионов пятой группы.
Аналитические реакции катионов Sb (III, V).
а) Реакция с металлическим оловом Sn. В пробирку вносят несколько капель солянокислого раствора хлорида сурьмы (III, V) и кусочек металлического олова. Поверхность металла чернеет вследствие выделения хлопьевидного осадка свободной сурьмы: 2H[SbCI4] + 3Sn → 2Sb↓ + 3SnCI2 + 2HCI
б) Реакция с сероводородом H2S. В пробирки вносят по 3 капли солянокислых растворов хлоридов сурьмы (III, V), по 2 капли концентрированной соляной кислоты и прибавляют по каплям раствор сероводородной воды или раствора сульфида натрия. Выпадают оранжевые осадки сульфидов сурьмы (III, V):
2[SbCI4]- + 3S2- → Sb2S3 + 8CI-
2[SbCI6]- + 5S2- → Sb2S5 + 12CI-
В избытке сульфат-ионов осадки растворяются с образованием тиосолей:
Sb2S3 ↓ + 3S2- → 2[SbS3]3-
Sb2S5 ↓ + 3S2- → 2[SbS4]3-
Растворение осадков происходит также в присутствии сильных щелочей:
Sb2S3 ↓ + 4NaOH → Na [Sb (OH)4] + Na3SbS3
4Sb2S5 ↓ + 18NaOH → 3Na [Sb (OH)6] + 5Na3SbS4
Выполнение реакции. В пробирку вносят 3 капли солянокислого раствора хлорида сурьмы (III, IV), 2 капли концентрированной HCI и прибавляют по каплям раствор сульфида аммония или сульфида натрия или сероводородную воду. Выпадает оранжевый осадок сульфида сурьмы (III, IV).
в) Реакция с 1-(2-Пиридилазо)-2-нафтол (ПАН) в сильно кислом растворе образует с [SbCl6]3- красно-фиолетовое соединение, экстрагируемое бензолом. Природа соединения неизвестна. Мешают ионы меди (II), для устранения влияния которых вводят тиомочевину. Тиомочевина восстанавливает ионы сурьмы (III) до ионов сурьмы (V), а ионы меди (II) до ионов меди (I) и образует с последними устойчивый растворимый в воде бесцветный комплекс. Соединение сурьмы с ПАН рекомендуется экстрагировать через 1-2 мин после добавления всех реагентов.
Выполнение реакции. К 2-3 каплям раствора, содержащего ионы сурьмы, добавляют 5 капель 4 моль/дм3 НCl, тиомочевину до растворения образующегося осадка, кристаллический КBr на кончике шпателя, 2-3 капли 0,10 %-ого этанольного раствора ПАН, бензол и перемешивают. В присутствии сурьмы органическая фаза окрашивается в красно-фиолетовый цвет. Необходимо провести контрольный опыт.
г) Реакция с родамином Б. В пробирку вносят 3-4 капли солянокислого раствора сурьмы (V), прибавляют 2-3 капли концентрированной соляной кислоты,1 см3 дистиллированной воды, 3-4 капли раствора родамина Б и 5-6 капель бензола. Встряхивают смесь. Органический (бензольный) слой окрашивается в фиолетово-синий цвет. В случае присутствия в растворе сурьмы (III) реакцию проводят аналогично, за исключением того, что после прибавления концентрированной соляной кислоnы в пробирку добавляют дополнительно 2-3 капли раствора нитрита натрия.
д) Реакция с бромоводородной кислотой HBr. В зависимости от концентрации HBr может образовывать с ионами сурьмы (III) различные по составу комплексные соединения: SbBr4- , SbBr5-2, SbBr6-3. Замороженные при -196 С (жидкий азот) растворы сурьмы (III) в 1-9 моль/дм3 HBr в отличие от сурьмы (V) способны люминесцировать оранжево-красным светом. Это позволяет определить степень окисления сурьмы и обнаружить сурьму (III) в присутствии сурьмы (V). Реакцию проводят на фильтровальной бумаге. Предел обнаружения сурьмы – 0,003 мкг. Реакция довольно селективна.
Аналитические реакции катионов висмута Bi (III).
а) Реакция с хлоридом олова (II) в щелочной среде. Данная реакция является весьма чувствительной. К раствору SnCl2 прибавляют столько разбавленной щелочи, чтобы сначала выделившийся осадок растворился:
Sn2+ + 2OH- → Sn(OH)2↓;
Sn(OH)2↓ + 2OH- → [Sn(OH)4]2-
и затем прибавляют исследуемый раствор. При этом от избытка КОН выделяется белый аморфный осадок Bi(OH)3, который мгновенно чернеет вследствие выделения металлического висмута:
Bi3+ + 3OH- → Bi(OH)3↓
2Bi(OH)3↓ + 3SnO22- → 2Bi↓ + 3SnO32- + 3H2O
Выполнение реакции. К 2-3 каплям раствора, содержащего ионы олова (II), прибавляют по каплям 30,00%-ный раствор NaOH до образования осадка гидроксида олова (II) и последующего его растворения. К полученному раствору добавляют каплю раствора нитрата висмута. Образуется черный осадок.
б) Реакция с иодидом калия KI. В пробирку вносят 5 капель солянокислого раствора хлорида висмута и прибавляют по каплям раствор KI до выпадения черного осадка иодида висмута. Дальнейшее прибавление избытка раствора иодида калия приводит к растворению осадка и образованию оранжевого раствора:
[BiCl6]3- + 3I- → BiI3↓ + 6Cl-
BiI3↓ + I- → [BiI4]-
Разбавление полученного раствора водой приводит к выпадению осадка с последующим его гидролизом и образованием желто-оранжевого оксоиодида висмута.
[BiI4]- + H2O → BiOI + 3I- + 2H+
Выполнение реакции. В пробирку вносят около 5 капель солянокислого раствора хлорида висмута (III) и прибавляют по каплям раствор KI до выпадения черного осадка иодида висмута (III). Дальнейшее прибавление избытка раствора KI приводит к растворению осадка и образованию оранжевого раствора. При прибавлении воды к этому раствору и его нагревании образуется оранжевый осадок иодида висмутила BiOI.
в) Реакция с соляной кислотой HCl. Bi3+ образует с НCl комплексные ионы [BiCl5]2- (в 1-8 моль/дм3 НCl) и [BiCl6]3- (в 8-11 моль/дм3 НCl). Замороженные растворы, содержащие ионы Bi3+ , в соляной кислоте обладают собственной низкотемпературной люминесценцией голубого цвета. Это свечение обусловлено электронной структурой ртутьподобного иона Bi3+ .
Выполнение реакции. На фильтровальную бумагу наносят каплю раствора, содержащего ионы Bi3+, и каплю 2 моль/дм3 НCl. Бумагу с влажным пятном пинцетом погружают в сосуд Дьюара с жидким азотом на 20-30 с. В присутствии висмута замороженное пятно на фильтровальной бумаге люминесцирует голубовато-синим светом.
г) Реакция с иодидом цезия CsI. В пробирку вносят 5 капель солянокислого раствора хлорида висмута и прибавляют по каплям раствор CsI. Выпадает черный осадок иодида висмута.
[BiCl6]3- + 3I- → BiI3↓ + 6CI-
Аналитические реакции катионов марганца Mn (II).
а) Реакция с оксидом свинца PbO2. Внести в пробирку небольшое количество двуокиси свинца, 1 мл концентрированной азотной кислоты и каплю раствора соли марганца. Смесь нагреть до кипения и кипятить 1-2 минуты. Затем смесь охладить, разбавить ее 8-10 каплями дистиллированной воды, центрифугировать. Появление малиновой окраски в растворе указывает на образование марганцевой кислоты.
2Mn(NO3)2 + 5PbO2↓ + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2H2O
Оксид свинца (IV), висмутат натрия, персульфат аммония в азотнокислой среде быстро окисляют ионы марганца (II) до марганцевой кислоты HMnO4, имеющей характерную красно-фиолетовую окраску. Окисление персульфатом аммония проводят в присутствии катализатора – ионов серебра (I), которые окисляются им до ионов серебра (II):
2Ag+ + S2O82- → 2Ag2+ + 2SO42-
Далее ионы серебра (II) окисляют ионы марганца (II) до перманганат-иона, а ионы серебра (I) при этом генерируются:
Mn2+ + 5Ag2+ + 4H2O → MnO4- + 5Ag+ + 8H+
Висмутат натрия окисляет ионы марганца (II) в отличие от других окислителей без нагревания. Предел обнаружения марганца – 2 мкг.
б) Реакция с 1-(2-Пиридилазо)-2-нафтолом (ПАН). ПАН образует с ионами марганца (II) при рН=7-10 малорастворимое в воде комплексное соединение красно-фиолетового цвета состава Mn(ПАН)2. Комплекс экстрагируется СНCl3, С6Н6, СCl4, спиртами.
в) Реакция сo щавелевой кислотой Н2С2О4. К 5-6 каплям раствора соли марганца (II) добавить 2-3 капли раствора едкого натра. Смесь тщательно перемешать стеклянной палочкой до образования бурого осадка марганцовистой кислоты.
Mn2+ + 2OH- → Mn(OH)2↓
2Mn(OH)2↓+ O2 →2H2MnO3↓
К бурому осадку прибавить 3-4 капли раствора щавелевой кислоты (не встряхивать). Образуется раствор розового цвета комплексного соединения марганца (II):
2H2MnO3 ↓+ 7H2C2O4 → 2H3[Mn(C2O4)] + 2CO2↑+ 6H2O
Аналитические реакции катионов железа Fe (II).
а) Реакция с гексацианоферратом (III) калия – феррицианидом калия K3[Fe(CN)6] (фармакопейная). Катионы железа Fe2+ реагируют с феррицианидом калия в кислой среде с образованием темно-синего осадка «турнбулевой сини» K3[Fe(CN)6]. При образовании этого осадка осуществляется окислительно-восстановительный процесс с переносом электрона от «внешнесферного» Fe2+ к «внутрисферному» Fe3+:
Fe2+ + [Fe3+(CN)6]3- → Fe3- + [Fe2+ (CN)6]4-
Образовавшиеся Fe3+-ионы образуют с анионом гексацианоферрата (II) новый комплексный анион:
Fe3+ + K+ + [Fe2+ (CN)6]4- → K[Fe2(CN)6]↓ или KFe3+[Fe2+(CN)6]
Соединение KFe3+[Fe2+(CN)6] носит тривиальное название «турнбулевой сини» и по данным рентгеноструктурных исследований идентично с «берлинской лазурью» KFe3+[Fe2+(CN)6], получаемой при реакции Fe3+ с K4[Fe(CN)6]. Реакция проводится в кислой среде. Чувствительность 0,05мкг. Осадок «турнбулевой сини» не растворяется в кислотах, но разлагается в щелочной среде.
Выполнение реакции. В пробирку вносят 2-3 капли раствора соли железа (II), прибавляют 1-2 капли раствора HCl и 2-3 капли раствора феррицианида калия K3[Fe(CN)6]. Раствор окрашивается в синий цвет и выделяется синий осадок «турнбуленовой сини».
б) Реакция с диметилглиоксимом в аммиачной среде образует с Fe2+ карминово-красный комплекс диметилглиоксимат железа (II):

Определению Fe2+ мешают катионы Ni2+. Чувствительность реакции 0,4мкг.
в) Реакция с сульфидом аммония (фармакопейная). Сульфид аммония образует с солями железа (II) черный осадок FeS:
Fe2+ + S2- → FeS↓
Осадок растворим в разведенных минеральных кислотах. Растворимость FeS в минеральных кислотах послужила основанием для включения Fe2+ в группу катионов, осаждаемых (NH4)2S.
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли железа (II) и прибавляют 2-3 капли раствора сульфида аммония (NH4)2S (или сульфида натрия). Выпадает черный осадок сульфида железа (II).
г) Реакция с гидроксидами. Гидроксиды щелочных металлов осаждают зеленый осадок Fe(OH)2, буреющий на воздухе вследствие окисления кислородом до Fe(OH)3: Fe2+ + 2OH- → Fe(OH)2↓(серо-зеленый осадок)
4Fe(OH)2↓ + O2 + H2O → 4Fe(OH)3↓(бурый осадок)
Осадок нерастворим в избытке щелочей, что дало основание отнести Fe2+ по кислотно-основной классификации к группе катионов, гидроксиды которых нерастворимы в щелочах.
Выполнение реакции. а) В пробирку вносят 5-6 капель раствора соли железа (II) и по каплям прибавляют раствор NaOH до прекращения выпадения белого осадка Fe(OH)3 . На воздухе осадок постепенно темнеет.
б) К свежеприготовленному, как описано выше, белому осадку Fe(OH)2 прибавляют по 2-3 капли растворов NaOH и H2O2. Окраска осадка изменяется до красно-бурой.
д) Другие реакции катионов железа (II) Fe2+. Катионы Fe2+ образуют в кислой среде комплексные соединения розово-красного цвета с 2,2-дипиридилом и о-фенантролином.
Аналитические реакции катионов железа Fe (III).
а) Реакция с гексацианоферратом (II) калия - ферроцианидом калия K4[Fe(CN)6] (фармакопейная). Катионы Fe3+в кислой среде реагируют с ферроцианидом калия с образованием темно-синего осадка «берлинской лазури» – комплексного соединения гексацианоферрата (II) железа (III) Fe4[Fe(CN)6]3 х H2O с переменным количеством молекул воды. Показано, что в зависимости от условий осаждения, осадок «берлинской лазури», как и осадок «турнбулевой сини» (см. выше), увлекает из раствора другие катионы, так что его состав меняется и может соответствовать формуле KFe3+[Fe2+(CN)6]:
Fe3+ + K+ + [Fe(CN)6]4- → FeK[Fe(CN)6]↓
Реакция специфична. Проведению реакции мешают окислители, окисляющие реактив.
Выполнение реакции. В пробирку вносят 2-3 капли раствора соли железа (III), прибавляют 1-2 капли раствора HCl и 2 капли раствора K4[Fe(CN)6]. Раствор окрашивается в синий цвет и выпадает темно-синий осадок «берлинской лазури».
б) Реакция с тиоцианат-ионами (фармакопейная). Соли Fe3+ образуют тиоцианат железа (III) красного цвета. Реакция проводится в кислой среде. Состав образующегося комплекса непостоянен и может в зависимости от концентрации ионов Fe3+ и SCN- от [Fe(SCN)]2+ до [Fe(SCN)6]3-. Эта реакции иногда используется для обнаружения железа в комбинации с реакцией 1, с гексацианоферратом (II) калия. Сначала добавлением NH4SCN получают красный комплекс тиоцианата железа, который затем добавлением гексацианоферрата (II) калия переводят в синий осадок гексацианоферрата (II) железа (III) калия:
Fe3+ + 3SCN-→Fe(SCN)3
Чувствительность реакции 0,25мкг. Проведению реакции мешают анионы кислородных кислот (фосфорной, мышьяковой и др.), фториды, образующие соединения с Fe3+ и NO2, дающий SCN- соединение NOSCN красного цвета.
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли железа (III) и прибавляют 2-3 капли раствора тиоцианата аммония NH4NCS или калия KNCS. Раствор окрашивается в синий цвет.
в) Реакция с сульфидом натрия (фармакопейная). Сульфид натрия осаждает из нейтральных и слабощелочных растворов солей железа (III) осадок черного цвета Fe2S3:
2Fe3+ + 3S2- → Fe2S3↓
Осадок Fe2S3 растворим в минеральных кислотах.
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли железа (III) и прибавляют 2-3 капли раствора сульфида аммония, либо сероводородной воды. Выделяется черный осадоксульфида железа (III).
г) Реакция с гидроксидами. Осадок гидроксида железа (III) Fe(OH)3, получающийся при взаимодействии Fe3+ с гидроксид-ионами, нерастворим в растворах щелочей и поэтому по кислотно-основной классификации Fe3+ относят к группе катионов, гидроксиды которых нерастворимы в щелочах. Осадок Fe(OH)3 растворим в разбавленных кислотах; не растворим в насыщенном растворе хлорида аммония (в отличие от белого осадка Fe(OH)2).
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли железа (III) и прибавляют 3-4 капли NaOH. Выпадает красно-бурый осадок гидроксида железа (III) Fe(OH)3.
д) Реакция с сульфосалициловой кислотой (фармакопейная). Катион Fe3+ реагирует в водных растворах с сульфосалициловой кислотой при рН ≈ 9-11,5 с образованием желтых комплексов: Fe3+ + L2-→[FeL3]3-, где L2- - обозначение сульфосалицилат-аниона, образовавшегося из сульфосалициловой кислоты при отщеплении двух протонов предположительно от групп –СООН и –SО3Н. Наиболее устойчив комплекс желтого цвета, содержащий железо (III) и анионы сульфосалициловой кислоты в мольном соотношении железо (III): сульфосалицилат-анионы, равном 1:3, т.е. на один атом железа приходится три сульфосалицилатных лиганда. Этот комплекс доминирует в аммиачном растворе. Точное строение комплексов в растворе неизвестно. Чувствительность реакции 5-10мкг.
Выполнение реакции. В пробирку вносят ~5 капель раствора соли железа (III), прибавляют ~10 капель раствора сульфосалициловой кислоты и ~0,5 мл концентрированного раствора аммиака. Раствор принимает желтую окраску.
Аналитические реакции катионов магния (II).
а) Реакция со щелочами. Растворы щелочей выделяют из растворов солей магния белый студенистый осадок гидроксида магния Mg(OH)2, легко растворимый в кислотах и растворах аммонийных солей:
Mg(OH)2↓ + 2HCl → MgCl2 + 2H2O
Mg(OH)2↓ + 2NH4Cl → MgCl2 + 2NH4OH
Выполнение реакции. К 1-2 каплям раствора, содержащего ионы магния, прибавляют 2 - 3 капли 1 моль/дм3 NaOH. Образуется белый студенистый осадок. Полученный осадок делим на 2 пробирки. В 1-ую пробирку прибавляем 3-4 капли HCl, осадок растворяется. Во 2-ую пробирку прибавляем 3-4 капли NH4Cl, осадок так же растворяется.
б) Реакция с гипоиодитом калия. При взаимодействии йода со щелочью образуется гипоиодит калия KIO; при этом равновесие в растворе смещается вправо и он обесцвечивается:
I2 + 2OH-↔I- + IO- + H2O
При добавлении соли магния ионы Mg2+ образуют с ионами ОН- осадок Mg(OH)2, что вызывает смещение равновесия влево. Выделяющийся при это йод адсорбируется осадком Mg(OH)2 и окрашивает его в красно-бурый цвет.
Выполнение реакции. Раствор Люголя обесцвечивают прибавляя по каплям раствор КОН. К полученному бесцветному раствору прибавляют раствор соли магния. Тотчас выделяется аморфный осадок, окрашенный в красно-бурый цвет.
в) Реакция с
гидрофосфатом натрия (фармакопейная).
Гидрофосфат
натрия
образует
с ионами магния в присутствии
NH3
при рН~9 белый кристаллический осадок
![]() :
:
![]()
При рН> 10 могут образоваться Mg(OH)2 и Mg3(PО4)2. Рекомендуется к кислому анализируемому раствору прибавлять NH3 до рН ~9. Из за образования NH4C1 рН раствора поддерживается постоянным. Осадок растворяется в сильных кислотах и в уксусной кислоте:
MgNH4PO4↓+ 3HCl→ H3PO4 + MgCl2 + NH4Cl
MgNH4PO4↓+ 2CH3COOH→Mg(CH3COO)2 + NH4H2PO4
Предел обнаружения магния - 10 мкг. Мешают ионы, образующие малорастворимые фосфаты; NH4+, K(I) и Na(I) не мешают.
Выполнение реакции. К 1-2 каплям раствора, содержащего ионы магния, прибавляют 2 - 3 капли 2 моль/дм3 НСl, 1 каплю раствора Na2HPО4 и при перемешивании по каплям прибавляют 2 моль/дм3 NH3 до появления запаха аммиака (рН ~9). Выпадает белый кристаллический осадок.
г) Реакция с 8-оксихинолином (люминесцентная реакция). 8-Оксихинолин образует с ионами магния при рН 9 - 12 флуоресцирующий зеленым светом оксихинолинат:
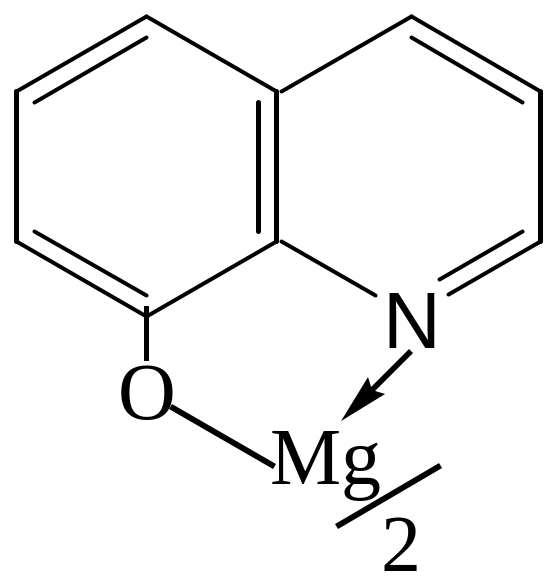
Предел обнаружения магния - 0,025 мкг. Интенсивность свечения повышается при обработке влажного пятна с оксихинолинатом магния раствором NH3. Мешают А1(III), Zn(II).
Выполнение реакции. На фильтровальную бумагу наносят каплю раствора, содержащего ионы магния, и каплю этанольного раствора реагента. Образующийся оксихинолинат магния обрабатывают каплей 10%-ного раствора аммиака. При рассмотрении влажного пятна в ультрафиолетовом свете наблюдается зеленое свечение.
д) Реакция с хинализарином (1,2,5,8-тетраоксиантрахи-нон) (I). Хинализарин (1,2,5,8-тетраоксиантрахинон) (I) с ионами магния образует в щелочном растворе малорастворимое соединение синего цвета, которому приписывают структуру (II):


Предполагают, что хинализариновый лак является адсорбционным соединением гидроксида магния с реагентом. Весьма вероятно образование хелатов переменного состава.
Предел обнаружения магния - 5 мкг. Обнаружению не мешают ионы щелочноземельных металлов; в присутствии достаточно большого количества щелочи не мешают ионы алюминия.
Ион аммония мешает обнаружению иона магния, так как препятствует образованию гидроксида магния. Раствор реагента в щелочной среде окрашен в фиолетовый цвет, поэтому необходимо проведение контрольного опыта.
Выполнение реакции. К 1 - 2 каплям раствора, содержащего ионы магния, добавляют 1 каплю раствора хинализарина и 2 капли 30%-ного раствора NaOH. Образуется осадок синего цвета. Для проведения контрольного опыта к 1 - 2 каплям воды добавляют одну каплю раствора хинализарина, 2 капли 30%-ного раствора NaOH. Раствор окрашивается в фиолетовый цвет.
