
- •2 Точка 1 семестр Молекулярность и порядок реакций
- •Зависимость скорости реакции от концентраций реагирующих веществ.
- •Зависимость скорости реакции от температуры.
- •Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Химическая термодинамика Первое начало термодинамики. Закон Гесса.
- •Химическая термодинамика. Основные термодинамические понятия.
- •Химическая термодинамика Второй закон термодинамики. Свободная энергия.
- •Принцип Ле-Шателье.
- •Костанта равновесия.
2 Точка 1 семестр Молекулярность и порядок реакций
1. Задание {{ 168 }} ТЗ № 168
К мономолекулярным реакциям относятся
+ Cl2 = 2Cl
+ CaCo3 = CaO+CO2
2. Задание {{ 169 }} ТЗ № 169
К бимолекулярным реакциям относятся
+ H2 + Cl2 = 2HCl
+ 2H2O2 = 2H2O + O2
3. Задание {{ 170 }} ТЗ № 170
Порядок реакции H2 + Cl2 = 2HCl равен
+ 2
4. Задание {{ 171 }} ТЗ № 171
Порядок реакции 2H2O2 = 2H2O + O2 равен
+ 1
5. Задание {{ 172 }} ТЗ № 172
Порядок реакции СO2 + С = 2СO равен
+ 1
6. Задание {{ 173 }} ТЗ № 173
П орядок
реакции С12
H22
O11
+ H2O
C6
H12
O6
+ C6
H12
O6
равен
орядок
реакции С12
H22
O11
+ H2O
C6
H12
O6
+ C6
H12
O6
равен
+ 1
7. Задание {{ 174 }} ТЗ № 174
Молекулярность реакции CaCO3 =CaO+CO2 равна
+ 1
8. Задание {{ 175 }} ТЗ № 175
Молекулярность реакции 2N2O5 = 4NO2 + O2 равна
+ 2
9. Задание {{ 176 }} ТЗ № 176
Порядок реакции в многостадийных реакциях определяется
+ самой медленной стадией
10. Задание {{ 177 }} ТЗ № 177
Самая медленная стадия многостадийной реакции определяет её
+ порядок
11. Задание {{ 178 }} ТЗ № 178
Порядок реакции может быть
+ нулевым
+ первым
+ дробным
+ вторым
+ третьим
12. Задание {{ 179 }} ТЗ № 179
Порядок реакции не может быть
+ отрицательным
13. Задание {{ 180 }} ТЗ № 180
В реакции 2H2O2 = 2H2O + O2 медленной стадией является
+ 2H2O = 2H2 + O2
14. Задание {{ 181 }} ТЗ № 181
Лимитирующей стадией процесса является
+ самая медленная
Зависимость скорости реакции от концентраций реагирующих веществ.
1. Задание {{ 464 }} ТЗ № 464
Отметьте правильный ответ
В ыражение
закона действия масс для реакции 2NO(г)
+ Cl2(г)
2NOCl(г)
ыражение
закона действия масс для реакции 2NO(г)
+ Cl2(г)
2NOCl(г)
+ V=K[NO]2 [Cl2]
2. Задание {{ 465 }} ТЗ № 465
Отметьте правильный ответ
В ыражение
закона действия масс для реакции CaCO3(к)
CaO(к)
+ CO2(г)
ыражение
закона действия масс для реакции CaCO3(к)
CaO(к)
+ CO2(г)
+ V=K
3. Задание {{ 466 }} ТЗ № 466
Отметьте правильный ответ
Выражение V=K[O2] соответствует реакции
+ С + О2=СО2
4. Задание {{ 467 }} ТЗ № 467
Отметьте правильный ответ
Скорость реакции зависит от концентрации обоих взаимодействующих веществ в случае
+ 2СО + О2=2СО2
5. Задание {{ 468 }} ТЗ № 468
Отметьте правильный ответ
С корость
реакции 2NO
+ O2
2NO2
при увеличении концентрации NO
в 3 раза
корость
реакции 2NO
+ O2
2NO2
при увеличении концентрации NO
в 3 раза
+ возрастает в 9 раз
6. Задание {{ 469 }} ТЗ № 469
Отметьте правильный ответ
С корость реакции NO(г) + Cl2(г) 2NOCl(г) при увеличении давления в 4 раза
+ увеличивается в 16 раз
7. Задание {{ 470 }} ТЗ № 470
Отметьте правильный ответ
Скорость химической реакции А(ж) + 2В(т)=Д(ж) при уменьшении количества вещества В в 2 раза
+ не изменится существенно
8. Задание {{ 471 }} ТЗ № 471
Отметьте правильный ответ
Скорость реакции 2NO2=N2O4 при увеличении концентрации NO2 в 5 раз увеличится в
+ 25 раз
9. Задание {{ 472 }} ТЗ № 472
Отметьте правильный ответ
Период полураспада одного из изотопов радия составляет 26,8 мин. Константа распада (с-1) равна
+ 0,69/26,8*60
10. Задание {{ 473 }} ТЗ № 473
Отметьте правильный ответ
С корость
реакции 2NO
+ O2
2NO2
при одновременном уменьшении концентрации
NO
и О2
в 2 раза
корость
реакции 2NO
+ O2
2NO2
при одновременном уменьшении концентрации
NO
и О2
в 2 раза
+ уменьшается в 8 раз
11. Задание {{ 474 }} ТЗ № 474
Отметьте правильный ответ
Скорость реакции СО(г) + 2Н2(г) = СН3ОН(г) при увеличении давления в 3 раза
+ увеличивается в 27 раз
12. Задание {{ 475 }} ТЗ № 475
Отметьте правильный ответ
Период полураспада 4 дня. Константа скорости процесса (с-1) равна
+
0,69/4![]() 24
3600
24
3600
13. Задание {{ 476 }} ТЗ № 476
Отметьте правильный ответ
Период полураспада радия равен 4,989 дня. Константа скорости распада (с-1) равна
+ 0,69/4,989 24 3600
14. Задание {{ 477 }} ТЗ № 477
Отметьте правильный ответ
С корость
химической реакции 2SO2(г)
+ O2(г)
2SO3(г)
при увеличении концентрации SO2
в 3 раза
корость
химической реакции 2SO2(г)
+ O2(г)
2SO3(г)
при увеличении концентрации SO2
в 3 раза
+ увеличится в 9 раз
15. Задание {{ 478 }} ТЗ № 478
Отметьте правильный ответ
С корость реакции 2NO(г) + O2(г) 2NO2(г) при уменьшении объема реакционного сосуда в два раза
+ увеличивается в 8 раз
16. Задание {{ 479 }} ТЗ № 479
Отметьте правильный ответ
Скорость реакции за промежуток времени можно рассчитать по формуле
+
V= -![]() С/
t
С/
t
17. Задание {{ 480 }} ТЗ № 480
Отметьте правильный ответ
С корость
реакции С+О2
СО2
можно рассчитать по формуле
корость
реакции С+О2
СО2
можно рассчитать по формуле
+ V=K[O2]
18. Задание {{ 481 }} ТЗ № 481
Отметьте правильный ответ
Скорость химической реакции выражается в
+ моль л-1 с-1
+ мольл л-1 мин-1
19. Задание {{ 482 }} ТЗ № 482
Отметьте правильный ответ
Константа скорости реакции для реакций первого порядка рассчитывается по уравнениям
+
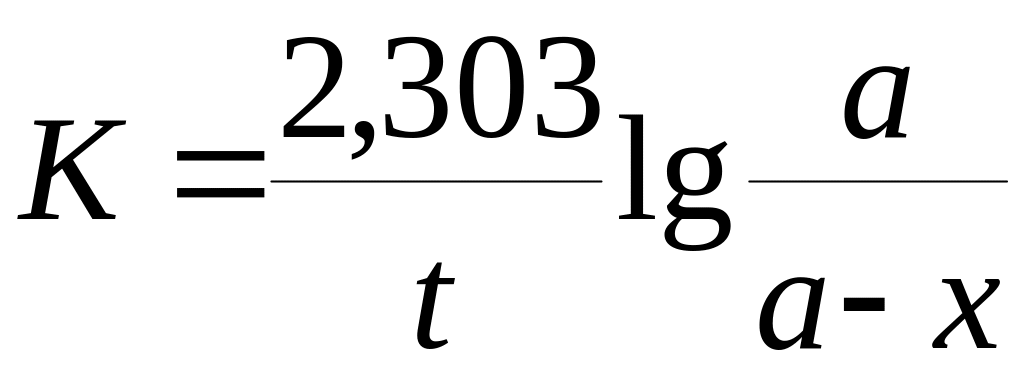
+
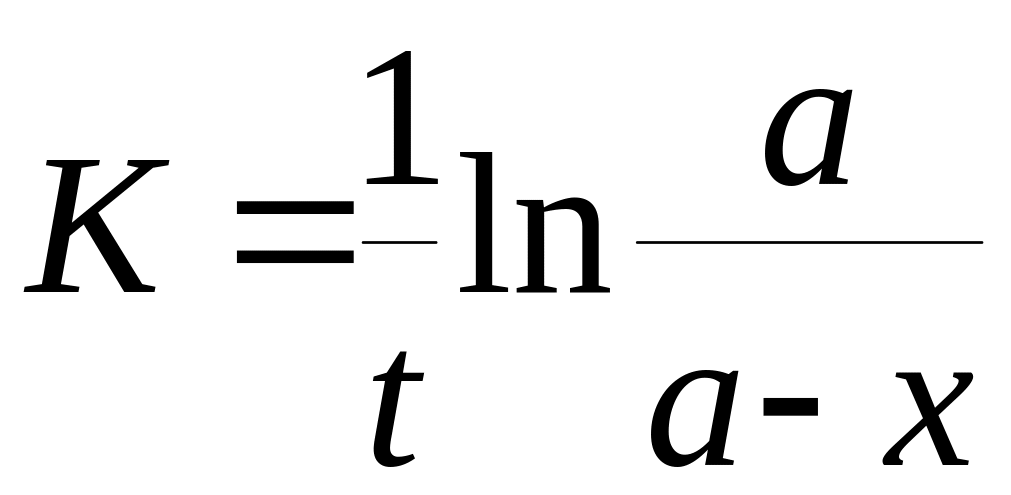
20. Задание {{ 483 }} ТЗ № 483
Отметьте правильный ответ
Константа скорости реакции для реакций второго порядка, когда концентрации реагирующих веществ равны между собой (а=в) рассчитываются по уравнениям
+
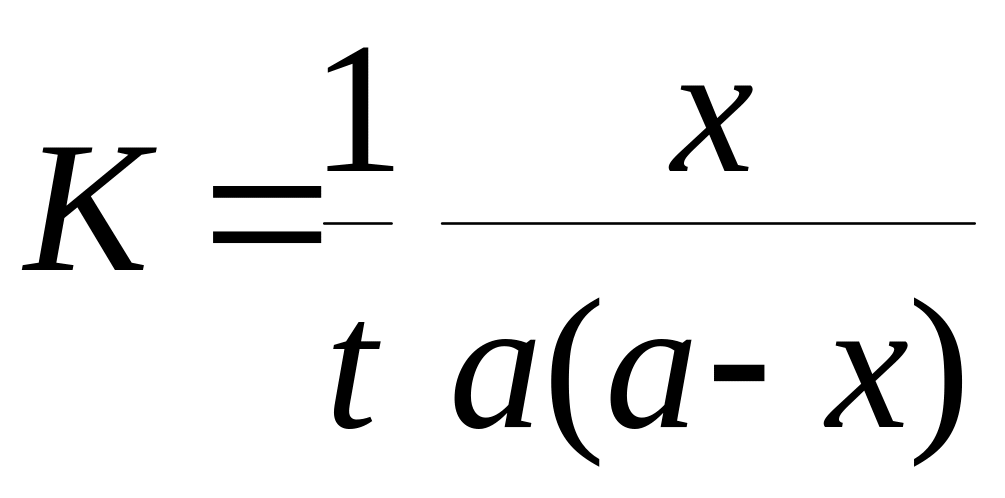
+
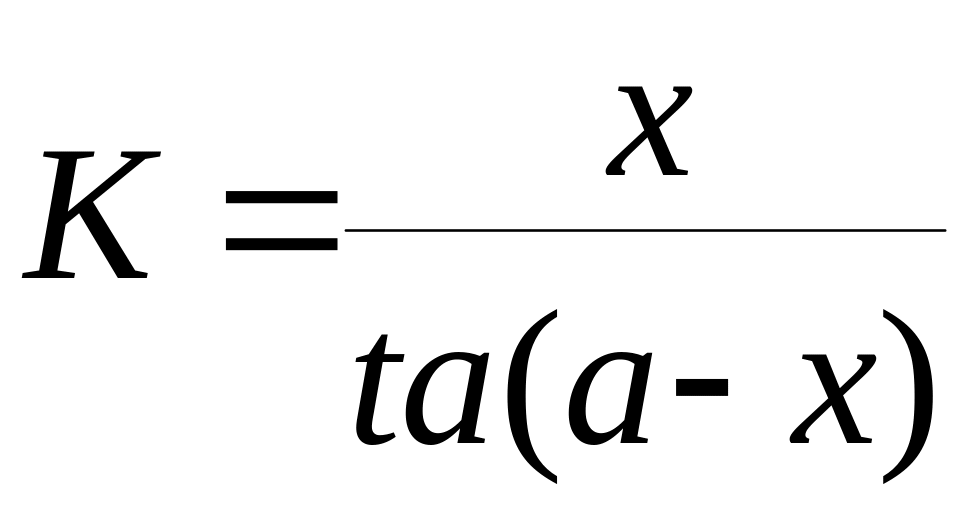
21. Задание {{ 484 }} ТЗ № 484
Отметьте правильный ответ
При увеличении давления в 4 раза скорость реакции А(г) + В(т)=АВ(т)
+ возрастает в 4 раза
22. Задание {{ 485 }} ТЗ № 485
Отметьте правильный ответ
Увеличение концентрации веществ А в 2 раза увеличит в 4 раза скорость реакции
+ 2А2(г) В(г)
23. Задание {{ 486 }} ТЗ № 486
Отметьте правильный ответ
Среднее
значение скорости (V)
гомогенной реакции по изменению
концентрации (С) или количества вещества
(![]() )
исходных веществ можно вычислить по
уравнениям
)
исходных веществ можно вычислить по
уравнениям
+ Vср.= - / t
+ Vср.= - С/ t
+ Vср.= - /V t
24. Задание {{ 487 }} ТЗ № 487
Отметьте правильный ответ
Г рафик зависимости скорости реакции А+В С от концентрации одного из исходных веществ имеет вид
+
V
C
25. Задание {{ 488 }} ТЗ № 488
Отметьте правильный ответ
Для зависимости скорости прямой реакции от времени наиболее типичен график
+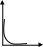
V
t
