
- •Часть I. Растворы
- •I. Общая характеристика растворов
- •II. О теориях растворов
- •III. Коллигативные свойства растворов
- •III.1. Закон Рауля. Лабораторная работа №1. Влияние концентрации малолетучей примеси на давление насыщенного пара над раствором на основе летучего растворителя
- •III.2. Осмос. Лабораторная работа №2.
- •2. Выполнение эксперимента
- •5. Запись термограмм охлаждения
- •6. Устранение возможной метастабильной модификации галлия
- •16. Оформите работу. Сделайте выводы.
- •Программирование криотермостата на достижение необходимой температуры
16. Оформите работу. Сделайте выводы.
ЛИТЕРАТУРА
Уэндландт У. Термические методы анализа. М.: Мир, 1978. 526 С.
Дифференциально-термический анализ металлов и сплавов: метод. указания к лаб. работе N 713 по курсу "Физика" для студентов, обучающихся по специальности 010701 "Физика" / Урал. гос. техн. ун-и - УПИ ; [сост. В. М. Замятин, О. П. Московских ; науч. ред. Ф. А. Сидоренко]. - Екатеринбург: УГТУ-УПИ, 2006. - 10 с.: URI: http://hdl.handle.net/123456789/2115
Я.Шестак. Теория термического анализа. М. Мир, 1987. 338 С.
ПРИЛОЖЕНИЕ
Программирование криотермостата на достижение необходимой температуры
Включите выключатель (красного цвета) на управляющей головке криотермостата ТЖ-ТС-01. На панели должно загореться сообщение «Start» после чего прибор перейдет в режим достижения введенной температуры.
Нажмите кнопку «» (правая нижняя в ряду управляющих кнопок прибора) и, пользуясь стрелками «» и «», требуемую Снова нажмите на кнопку «». Эта процедура даст прибору задание на установление указанной температуры в приборе. Если указанная температура уже выставлена на индикаторе, сразу нажмите кнопку «». (Здесь и далее: в случае, если заданного Вами изменения температуры не происходит, попробуйте выключить и включить прибор)
ПРИЛОЖЕНИЕ 1
Вывод осмотического уравнения Вант-Гоффа
Уравнение Вант-Гоффа для идеальных растворов можно получить на основании термодинамических соображений. Растворитель будет проникать в раствор через полупроницаемую перегородку до тех пор, пока в системе не установится равновесие. При равновесии химические потенциалы растворителя в растворе (μ1) и в чистом растворителе (μ1) будут одинаковы
μ1 = μ1. (П.1)
При постоянных температуре (T) и давлении (P)
μ1 = const, (П.2)
а
μ1 = f(P1, x1) (П.3),
где Р1 = Ρ + ; Ρ — давление, при котором находится раствор (а, изначально – находился и растворитель), — осмотическое давление. Под x1 будем понимать молярную долю растворителя, под x2 – молярную долю примеси, которая задерживается перегородкой.
Так как
μ1 = f(P1, x1),
то (П.4)
 . (П.5)
. (П.5)
В условиях равновесия при учете (П.1) и (П.2)
![]() (П.6)
(П.6)
Следовательно,
 (П.7)
(П.7)
Так как
 , (П.8)
, (П.8)
то
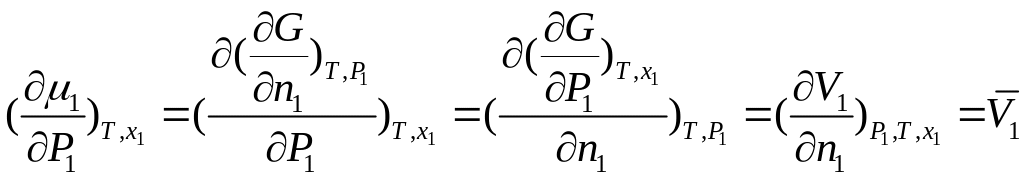 (П.9)
(П.9)
где
![]() —
парциальный молярный объем растворителя.
При дифференцировании уравнения (П.10)
по х1
получаем
(П.11):
—
парциальный молярный объем растворителя.
При дифференцировании уравнения (П.10)
по х1
получаем
(П.11):
![]() (П.10)
(П.10)
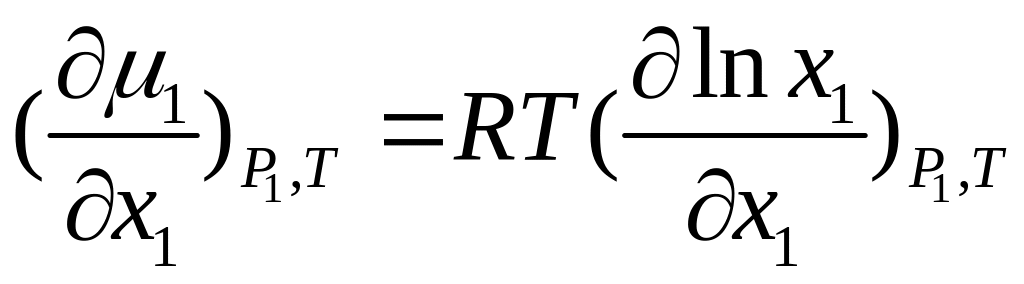 . (П.11)
. (П.11)
Выражения (П.9) и (П.11) подставляем в (П.7) и получаем
 (П.12)
(П.12)
При интегрировании (П.12) от P1 = P до P1 = P+ и от x1=1 до x1 в предположении, что не зависит от x1 и P1, получаем:
 ;
;
 . (П.13)
. (П.13)
Для
идеального раствора
![]() —
молярный объем чистого растворителя.
Поэтому в идеальном растворе
—
молярный объем чистого растворителя.
Поэтому в идеальном растворе
 . (П.14)
. (П.14)
В разбавленных растворах молярная доля примеси x2 близка нулю. Это позволяет воспользоваться разложением
 (П.15)
(П.15)
Далее учтем, что n2<<n1, поэтому
 (П.16)
(П.16)
Подставляем (П.15) и (П.16) в (П.14), и, ограничиваясь в (П.15) первым членом, получаем уравнение Вант-Гоффа:
 , (П.17)
, (П.17)
где С2 – молярная концентрация примеси в растворе.
1 Здесь и далее при использовании терминов твердое тело (фаза) и твердые растворы будем подразумевать их кристаллическую организацию.
2 Напомним, что под сложными понимаются вещества, образованные атомами различных элементов.
3 В некоторых твердых растворах имеются аналогичные, однако это тема для отдельного разговора.
