
- •Часть I. Растворы
- •I. Общая характеристика растворов
- •II. О теориях растворов
- •III. Коллигативные свойства растворов
- •III.1. Закон Рауля. Лабораторная работа №1. Влияние концентрации малолетучей примеси на давление насыщенного пара над раствором на основе летучего растворителя
- •III.2. Осмос. Лабораторная работа №2.
- •2. Выполнение эксперимента
- •5. Запись термограмм охлаждения
- •6. Устранение возможной метастабильной модификации галлия
- •16. Оформите работу. Сделайте выводы.
- •Программирование криотермостата на достижение необходимой температуры
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ФАЗОВЫЕ РАВНОВЕСИЯ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СИСТЕМАХ
Часть I. Растворы
Учебно-методическое пособие для студентов и магистров по специальности 020100– Химия ДО
Воронеж, 2008
Утверждено научно-методическим советом химического факультета (27.11.2008 г., протокол № 5)
Составители: Завражнов А. Ю.,
Семенов В. Н.,
Березин С. С.,
Попов Д.Н.
Учебно-методическое пособие подготовлено на кафедре общей химии химического факультета Воронежского государственного университета.
Рекомендуется для студентов 1 курса химического факультета, обучающихся по специальности 020100 - Химическая технология, 1-го курса магистратуры, обучающихся по специальностям 020101 – Неорганическая химия, 020104 – физическая химия, 020110 – химия твердого тела, 020109 – химия, физика и механика материалов
I. Общая характеристика растворов
Классификация растворов
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в определенных пределах может непрерывно изменяться. По степени дисперсности (т.е. измельчения веществ) компонентов различают взвеси, коллоидные и истинные растворы. Во взвесях частицы настолько велики, что видны невооруженным глазом, в коллоидных растворах для их обнаружения уже потребуется ультрамикроскоп. Наконец, в истинных растворах дробление вещества идет до мельчайших частиц – молекул, ионов, а иногда, даже до атомов – которые не обнаруживаются никакими оптическими микроскопами. По причине максимальной дисперсности эти растворы устойчивы (если нет пересыщения), прозрачны (в какой-либо области спектра), не разделяются никакими фильтрами, кроме молекулярных. В дальнейшем будем рассматривать именно истинные растворы.
В растворах часто различают растворитель и растворенное вещество. Под растворителем понимают вещество, которое имеется в растворе в большем количестве. Остальные компоненты, присутствующие в растворе в меньших количествах, называются растворенными веществами. Однако такое деление на растворитель и растворенное вещество крайне условно, особенно если количества компонентов в растворе соизмеримы.
Концентрация растворов
Важной характеристикой раствора является его состав (концентрация компонентов). Для выражения концентраций раствора применяются различные способы. Здесь мы перечислим наиболее важные из них.
1. Молярная (мольная) доля (xi) – отношение количества данного компонента к сумме числа молей всех веществ в растворе
 , (I.1)
, (I.1)
где ni и nk— числа молей i-ого и k-ого компонентов соответственно, где k принимает значения от 1 до числа компонентов системы. Поскольку моль – мера количества вещества, то молярную долю можно представить, как относительное содержание частиц данного сорта (неважно каких – атомов, молекул, ионов, микрогранул и т.д.) в данном веществе.
Молярная доля – безразмерная величина, заключенная в промежутке от 0 до 1. Часто также говорят о молярной доле, выраженной в %.
2. Массовая доля (wi) – отношение массы данного компонента к общей массе раствора:
 , (I.2)
, (I.2)
где mi и mk - массы i-ого и k-ого компонентов соответственно. Также как и в предыдущем случае часто говорится о массовой доле, выраженной в % (wi×100).
В повседневной жизни мольную и массовую доли различают скорее интуитивно. Например, в надписи на бутылке “4% уксусная кислота” речь идет о массовой доле этого вещества в водном растворе. С другой стороны, когда говорят, что в такой-то группе находится 60% девушек, то, конечно же, имеют в виду “молярную долю” – никому не придет в голову взвешивать всех юношей и девушек в группе и определять массовую долю. В рамках естественных наук следует использовать только однозначные понятия.
3. Молярная концентрация (Сi) – это число молей i-ого компонента, приходящееся на единицу объема раствора.
![]() , (I.3)
, (I.3)
где Ni – число молей i-ого компонента, V – объем раствора.
В химической литературе молярная концентрация часто имеет размерность [моль/л] и кратко записывается как [М]. Например, надпись 1 М NaCl обозначает раствор поваренной соли концентрацией 1 моль/л и произносится как “одномолярный раствор натрий-хлор”.
Если
образующие раствор компоненты
неограниченно растворимы друг в друге,
то говорят, что в данной системе имеется
непрерывная
растворимость
или непрерывный
ряд растворов
(последний термин чаще относят к твердым
растворам). Во многих случаях, однако,
равновесная концентрация растворенного
вещества не может превышать некоторое
предельное значение, и существование
растворов ограничено некоторыми
областями составов (области гомогенности).
Например, в системе “NaCl тверд. - H2O жидк.”
при комнатной температуре и атмосферном
давлении предельная растворимость
хлорида натрия составляет 36,5 г на
100 г воды. В пересчете на молярные
доли это дает
![]() .
Поскольку вода и насыщенный раствор
NaCl
полностью смешиваются друг с другом,
то область гомогенности раствора
поваренной соли в воде простирается от
xNaCl = 0
до указанного предельного значения,
соответствующего границе области
гомогенности. Это означает, что выбор
любых промежуточных или граничных
концентраций приводит к полному
самопроизвольному растворению хлорида
натрия и образованию гомогенного
раствора.
.
Поскольку вода и насыщенный раствор
NaCl
полностью смешиваются друг с другом,
то область гомогенности раствора
поваренной соли в воде простирается от
xNaCl = 0
до указанного предельного значения,
соответствующего границе области
гомогенности. Это означает, что выбор
любых промежуточных или граничных
концентраций приводит к полному
самопроизвольному растворению хлорида
натрия и образованию гомогенного
раствора.
Растворимость различных твердых веществ в жидкостях колеблется в очень широких пределах. Например, растворимость трийодида галлия в воде составляет около 2 кг на 100 г воды. Тот же порядок растворимости (по массе) имеют некоторые соли урана (+6). С другой стороны, существует огромное количество веществ, имеющих ничтожно малую растворимость. Вместе с тем, анализ огромного количества экспериментального материала показывает, что в природе не существует полностью нерастворимых веществ. При помощи метода меченых атомов было показано, что даже сульфид ртути (+2) – одно из самых малорастворимых веществ в природе – все же способен растворяться в воде, хотя и в очень малых количествах.
Существование
как, непрерывной так и ограниченной
растворимости относится и к твердому
состоянию вещества. В частности, небольшое
количество воды растворяется в кристаллах
поваренной соли (до
![]() при обычных условиях). Таким образом, в
упоминавшейся уже системе
“NaCl тверд. ‑ H2O жидк.”
имеется 2 ограниченных раствора: на
основе воды и на основе NaCl.
при обычных условиях). Таким образом, в
упоминавшейся уже системе
“NaCl тверд. ‑ H2O жидк.”
имеется 2 ограниченных раствора: на
основе воды и на основе NaCl.
Наборы возможных фаз в двухкомпонентной системе удобно представить графически на концентрационном отрезке (рис. 1). В широкой области составов, простирающейся от xNaCl = 0,15 до xNaCl = 0,999995, рассматриваемая система оказывается гетерогенной. В ней независимо от общего состава существуют две фазы постоянного состава: насыщенный хлоридом натрия водный раствор и насыщенный водой твердый раствор на основе кристаллического NaCl. В гетерогенной области бесполезно пытаться получить в виде единственной фазы устойчивый раствор. Например, если для приготовления соляного раствора компоненты взяты в равном мольном соотношении (xNaCl=xH2O=0,5), то часть твердой соли останется в избытке. Составы, соответствующие границам областей гомогенности растворов, зависят от температуры и давления. Если влияние последнего обычно очень мало, то температура способна очень сильно менять предельную растворимость компонентов в жидких и твердых телах.

Рис. 1. Концентрационный отрезок системы H2O – NaCl для условий T = 293 K, P = 105 Па. (Устоявшееся научное название – изобарно-изотермическое сечение фазовой диаграммы системы H2O – NaCl.) Точка B отвечает границе области гомогенности водно-солевого раствора со стороны NaCl, т.е. насыщенному солью водному раствору. Также граничная точка C соответствует насыщенному твердому раствору воды в хлориде натрия. Отрезки AB и CD имеют смысл областей гомогенности ограниченных растворов (NaCl в H2O (жидк.) и H2O в NaCl (тв.) в данной системе при указанных условиях. Область гомогенности твердого раствора для наглядности многократно завышена.
Различные агрегатные состояния растворов. Растворы газов
Когда в повседневной жизни говорят о растворах, обычно имеют в виду жидкие растворы. Однако существуют и растворы газов, и твердые растворы, имеющие кристаллическую структуру. В качестве примера газовых растворов приведем воздух – раствор, состоящий, в основном, из четырех компонентов: азота (около 79 мол. %), кислорода (~20 %), аргона (~1 %) и углекислого газа (0,03 %). Смешение различных газов почти всегда приводит к образованию истинных растворов газов. Однако газы способны смешиваться во всех отношениях не при любых условиях. Возможность неполного смешения газов с образованием двух газообразных фаз, находящихся в равновесии, предвидел еще Ван-дер-Ваальс (1894). Экспериментально ограниченная взаимная растворимость газов была впервые установлена в середине XX века советскими учеными во главе с И.Р.Кричевским в системе аммиак — азот. При высоких давлениях (тысячи атмосфер) гомогенная газообразная система распадается на две газовые фазы с отчетливой границей раздела. К настоящему времени обнаружены и многие другие системы, обладающие этим свойством.
Согласно одной из гипотез, подтвержденной данными некоторых астрономических экспериментов, расслоение газов также имеет место в атмосфере планет-гигантов (Юпитер, Сатурн, Уран, Нептун).
Твердые растворы
При образовании твердых растворов, их состав оказывается варьируем за счет того, что узлы и междоузлия кристаллической решетки могут быть заняты различными компонентами – атомами, молекулами или ионами1. Важно отметить, что при образовании таких растворов тип кристаллической решетки растворителя сохраняется. Заметим, что далеко не любой сплав является твердым раствором. Очень часто сплавы металлов оказываются гетерогенными, т.е. по сути – взвесями, распад которых чрезвычайно замедлен по причине очень высоких значений вязкости в твердых телах.
Среди твердых растворов наиболее часто встречаются т.н. твердые растворы замещения, при образовании которых в узлах кристаллической решетки данного вещества атомы, молекулы и ионы замещаются частицами другого компонента. Только для этого типа растворов возможно возникновение непрерывного ряда твердых растворов (т.е. таких, в которых смешение возможно в любой области составов). Непрерывная растворимость встречается не слишком часто и возникает, если исходные компоненты близки по химическим свойствам, им отвечает один и тот же тип кристаллической структуры и число частиц в элементарной ячейке, а размеры частиц компонентов отличаются не более чем на 14—15%. Примеры: в системах Cu‑Au и Ag‑Au при высоких температурах (от 800 С до плавления) образуется непрерывный ряд твердых растворов замещения, а в системах Cu‑Ag, Sn‑Bi – только ограниченная растворимость по типу замещения.
Помимо твердых растворов замещения существуют также твердые растворы внедрения и вычитания. В двух последних возможна только ограниченная растворимость. Твердые растворы внедрения получаются путем внедрения частиц одного вещества в междоузлия кристаллической решетки другого вещества (растворителя), происходящие без изменения типа этой решетки. Растворы внедрения образуются в том случае, когда размеры частиц внедряемого вещества меньше размеров частиц растворителя. При внедрении новых частиц в промежутки между атомами металла происходит увеличение напряжений в кристаллической решетке. По этой причине область составов, в которой образуются твердые растворы внедрения, обычно невелика. Примеры: Такие объекты обычно возникают при растворении атомов легких неметаллов (водорода, азота, углерода, кислорода, бора, кремния) в металлах (прежде всего – в d- металлах IV, V и VI побочных подгрупп ПС).
Твердые растворы вычитания получаются, когда в структуре сложных твердых веществ2 в некоторых узлах кристаллической решетки вместо атомов имеются незанятые места – вакансии.
Проще всего заметную концентрацию вакансий в твердом веществе можно создать путем облучения тела частицами с высокими энергиями (-, -лучи и т.п.). В этом случае некоторые атомы просто “выбиваются” со своих позиций. Вместе с тем, некоторая концентрация вакансий (а также межузельных атомов) возникает при любой отличной от абсолютного нуля температуре. При этом, чем выше температура, тем большая равновесная концентрация точечных дефектов (т.е., вакансий и межузельных атомов) присутствует в твердом теле. Таким образом, выращенный даже в самых подходящих для формирования идеальной структуры кристалл всегда является дефектным. Следует заметить, что самопроизвольное достижение равновесной концентрации точечных дефектов осуществляется достаточно медленно даже при высоких температурах (часы и дни при T ~ 103 K). При быстром охлаждении твердого тела до комнатной или более низких температур почти всегда происходит сохранение достигнутой концентрации дефектов, которая продолжает существовать уже как неравновесная.
Концентрация вакансий, в зависимости от условий синтеза, может изменяться в некоторых пределах. Кроме того, эта концентрация, в общем случае, различается в разных подрешетках. В результате, состав растворов вычитания также может изменяться. В связи с этим такие объекты иногда называют твердыми растворами с дефектной решеткой. Примеры: кислородные, сернистые и мышьяковистые соединения d- металлов, находящихся в низких степенях окисления (Ti1‑O, Cr1‑S, Ni1‑As).
На примерах твердых растворов вычитания мы видим, что область гомогенности раствора (т.е. области составов, в пределах которой раствор существует как единственная фаза), не всегда включает в себя чистый компонент системы. Например, область гомогенности фазы Ti1‑O не включает в себя ни чистого титана (xTi = 1), ни чистого кислорода (xO = 1). Аналогично могут вести себя и твердые растворы внедрения. Если область гомогенности твердого раствора внедрения не захватывает чистого компонента, то обычно говорят о фазе внедрения, кристаллическая структура которой отличается от структуры, в которой кристаллизуется чистый компонент. При насыщении немолекулярного кристалла атомами, способными давать межузельные дефекты при небольших концентрациях примеси твердый раствор внедрения образуется без изменения исходной кристаллической структуры. Если же концентрация примеси превышает некоторую критическую концентрацию, то кристаллическая решетка перестраивается и образуется т.н. фаза внедрения, которая отделена от исходного твердого раствора гетерогенной областью.
Область гомогенности твердых растворов замещения также может быть отделена от каждого из компонентов системы гетерогенными областями. При рассмотрении таких растворов обычно выделяют еще один тип нарушений кристаллической структуры. Антиструктурные дефекты представляют собой атомы, находящиеся в узлах другой подрешетки. Например, в кристалле Ni1-Al часть атомов алюминия может занимать места, предназначенные кристаллической решеткой для атомов никеля.
Отметим, что в сложных веществах все три типа дефектов всегда присутствуют в твердом теле (пусть некоторые их них – в очень небольших концентрациях). По этой причине твердый раствор относят к одному из трех вышеперечисленных типов по признаку преобладания тех или иных нарушений структуры.
Вакансии, межузельные атомы и антиструктурные дефекты являются т.н. точечными дефектами. Подчеркнем, что только такие дефекты могут быть равновесными. Особенности точечных дефектов состоят в том, что
- во-первых, их концентрацией легко управлять, изменяя условия, в которых находится вещество и,
- во-вторых, даже ничтожная концентрация точечных дефектов способна очень сильно изменять свойства твердых веществ. Таким образом, свойства одного и того же вещества (материала) могут принципиально различаться за счет разной концентрации дефектов.
Жидкие растворы
На практике наиболее часто приходится встречаться с жидкими растворами. При образовании жидкого раствора растворенное вещество может находиться в виде отдельных молекул или ассоциатов, состоящих из нескольких молекул, либо частично или полностью подвергаться ионизации (диссоциации) на ионы. В связи с этим жидкие растворы подразделяются на растворы неэлектролитов и растворы электролитов.3
Электролиты и неэлектролиты
Согласно представлениям о химических взаимодействиях, все растворы могут быть разделены на две большие группы – растворы электролитов и неэлектролитов. В электролитах растворенная часть вещества подвергается – при непосредственном участии растворителя – полной или частичной ионизации (диссоциации) с образованием сольватированных ионов (т.е. ионов, окруженных молекулами или атомами растворителя). Например:
![]() , (I.4)
, (I.4)
где символ “aq” подчеркивает сольватированное (в данном случае – гидратированное) состояние ионов.
Различают слабые и сильные электролиты. Для последних ионизационное равновесие очень сильно смещено вправо, т.е. растворенное вещество практически полностью превращается в ионы. Из водных сред к сильным электролитам относятся растворы почти всех солей (за исключением солей кадмия, ртути и некоторых других тяжелых металлов), многие кислоты (например, хлорная, азотная, галогеноводородные – HCl, HBr и HI, трифторноуксусная CF3COOH) и основания (едкие щелочи: NaOH, KOH, азотистые основания ([N(CH3)4]OH) и др.).
К числу наиболее убедительных доказательств практически полной ионизации сильных электролитов относятся следующие.
1. При пропускании фотонов через поглощающий свет раствор (не обязательно в видимом глазом диапазоне) интенсивность поглощения света пропорциональна концентрации предполагаемых ионов. Если бы реакция ионизации была бы заметно обратимой, то интенсивность поглощения более слабо зависела от концентрации, поскольку разбавление увеличивает степень ионизации.
2. При нейтрализации водных растворов сильных кислот (HNO3, HClO4, HCl, HBr, HI и др.) сильными основаниями (NaOH, KOH и др.) независимо от природы кислоты и основания выделяется одно и то же количество теплоты (~56 кДж/моль). Это можно объяснить протеканием в растворе одной и той же реакции:
![]() , (I.5)
, (I.5)
где символ “aq” означает гидратированное состояние ионов.
3. Реакции сильных электролитов с образованием малодиссоциированных веществ (например, I.5.) протекают с очень высокой скоростью, которая (при очень интенсивном перемешивании растворов) почти не зависит от температуры. Расчеты показывают, что это возможно лишь в случае, когда практически любое соударение взаимодействующих частиц приводит к образованию молекул продукта, а это, в свою очередь, возможно только при полной ионизации исходных веществ.
В противоположность перечисленным, существует группа растворов, для которых реакция с образованием ионов является заметно обратимой. Это электролиты средней силы, либо слабые. К первым принадлежат, например, растворы плавиковой (HF), сернистой (H2SO3), муравьиной (HCOOH) кислот, гидроксидов лития и магния. К слабым электролитам относят некоторые кислоты (для водных растворов это H2CO3, H3BO3, C6H5OH и др.) и основания (Al(OH)3, NH3, C6H5NH2 и др.), а также некоторые комплексные соединения ([Fe(H2O)3(CNS)3] и др.). В случае электролитов средней силы и слабых электролитическое равновесие удобно характеризовать константой ионизации, которая является частным случаем константы равновесия (KC) и для разбавленных растворов связывает концентрации (Сi) различных ионных и молекулярных форм в растворе согласно закону Гульберта-Вааге. Важно подчеркнуть, что сама константа от этих концентраций не зависит (для разбавленных растворов). Например, для разбавленного водного раствора синильной кислоты (HCN) имеем:
![]() , (I.6)
, (I.6)
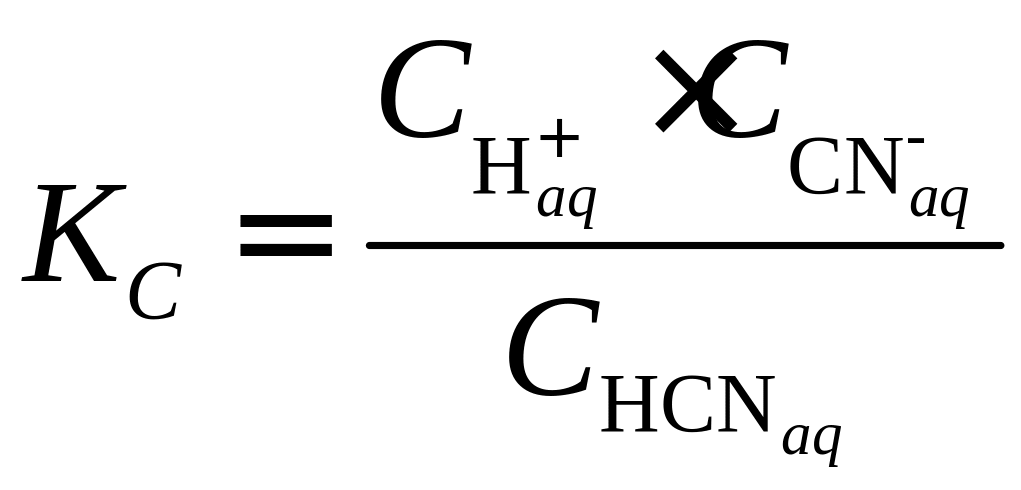 (I.7)
(I.7)
При стандартных условиях величина KC (HCN) = 7,910‑9.
Обычно говорят об электролите средней силы, если величина константы ионизации (диссоциации) находится в пределах от 10‑4 до 102. Слабые электролиты характеризуются величиной KC, меньшей 10‑4.
Ряд веществ при растворении подвергается ступенчатой ионизации. Например, для водных растворов орто-фосфорной кислоты при стандартных условиях имеем:
![]() , (I.8)
, (I.8)
![]() , (I.9)
, (I.9)
![]() . (I.10)
. (I.10)
Таким образом, орто-фосфорная кислота является кислотой средней силы, если говорить о первой ступени ионизации и слабой кислотой, если рассматривать две последующие ступени ионизации.
Общепринятым считается относить водный раствор серной кислоты к сильным электролитам. Однако это так, если речь идет об ионизации по первой ступени. При рассмотрении ионизации водной H2SO4 по второй ступени, этот электролит будет относиться к кислотам средней силы, т.к. KC2 = 1,210‑2.
Для сильных электролитов также может быть формально введена величина KC и записано выражение для ее связи с концентрациями молекул и ионов. Однако практически использовать такое выражение не представляется возможным (подумайте, почему).
Сила электролитов и способ их ионизации очень сильно зависят от природы растворителя. Например, азотная кислота, растворенная в серной кислоте, ведет себя как слабое основание, т.к. связывает ионы H+, возникающие при ионизации серной кислоты. Еще пример. Бензол, немного растворимый в воде, практически не подвергается ионизации в таких растворах. Однако раствор бензола в безводном фтороводороде уже является слабым электролитом.
Наконец, существует группа растворов, которые практически не содержат ионов. Их называют неэлектролитами. Заметим, что излагаемые ниже элементарные представления о теориях растворов были изначально сформулированы для неэлектролитов.
