
Лабораторная работа №5
«Химические свойства серы, азота, фосфора
и их соединений»
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
СЕРА
Сера S в свободном состоянии образует несколько аллотропных соединений, важнейшие из которых:
- сера (ромбическая)
- сера (моноклиническая)
Сера S встречается в природных условиях в виде залежей почти чистой самородной серы, а также входит в состав различных сульфидных руд:
FeS2 - железный колчедан (пирит);
ZnS - цинковая обманка;
CaSO4 - гипс;
HgS - киноварь;
Na2SO4∙10H2O - глауберова соль;
MgSO4∙7H2O - горькая соль.
Сера S входит в состав биологических тканей всех растений и живых организмов в форме аминокислот, таких как цистеин, цистин, метионин.
Химические свойства серы
Атом серы S, имеет незавершённый внешний энергетический уровень и может присоединять два электрона, проявляя степень окисления (-2).
При отдаче электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4, +6.
Сера S легко образует соединения со многими элементами. При сгорании её на воздухе или в кислороде образуется оксид серы (IV) SO2 и оксид серы (VI) SO3.


Сероводород и сульфиды
H2S - бесцветный газ с запахом тухлых яиц, хорошо растворим в воде. Очень ядовит - поражает нервную систему.
Получение
1. При нагревании серы S в водороде:

2. Действием разбавленных соляной (HCl) или серной (H2SO4) кислот на сульфид железа:

Химические свойства сероводорода – h2s
1. При сильном нагревании разлагается:

2. Газообразный сероводород горит на воздухе голубым пламенем:

3. Энергично реагирует с растворами галогенов:
![]()
4. Слабая сероводородная кислота H2S диссоциирует на ионы:
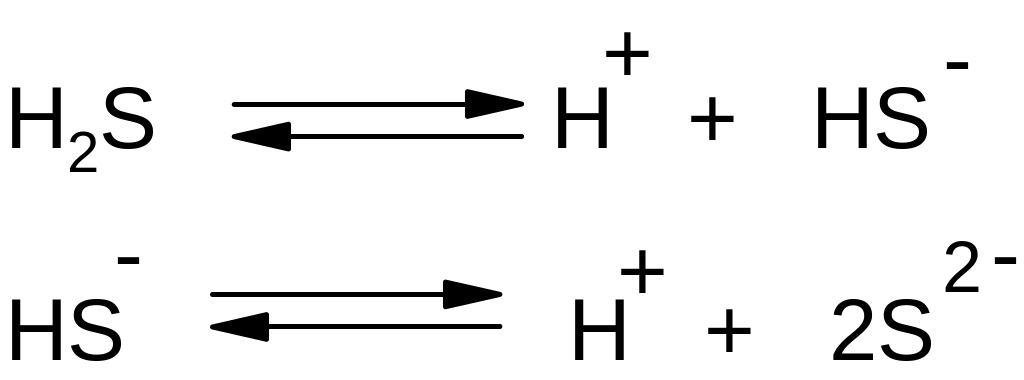
5. Сероводородная кислота H2S2- является восстановителем и окисляется как сильными окислителями, такими как хлор:
![]()
так и более слабыми окислителями:
![]()
Оксид серы (IV) - so2. Сернистая кислота (h2so3)
Оксид серы (IV) SO2- бесцветный газ, образуется:
1. При сгорании серы на воздухе:
![]()
2. При сгорании сероводорода:
![]()
3. При взаимодействии с некоторыми металлами:

4. При обжиге сульфидных минералов:

При растворении в воде образуется слабая сернистая кислота H2SO3 , которая мало устойчивая и вновь распадается на оксид серы (IV) SO2 и воду:
![]()
Кислота даёт два ряда солей: средние – сульфиты и кислые – гидросульфиты.
Оксид серы (VI) - SO3. Серная кислота (H2SO4)
Получение
1. Окисление на катализаторе и при высоком давлении:

2. При растворении в воде образуется серная кислота:
![]()
H2SO4 - сильная двухосновная кислота:

Азот
Азот N2 – газ без цвета,вкуса и запаха; легче воздуха.
Общее содержание азота в земной коре - 0,03%. Наибольшая его часть сосредоточена в атмосфере - N2 (около 78 об.%).
Азот N входит в состав растений и животных организмов (в форме белков). Растения синтезируют белки, используя нитраты из почвы.
Получение азота
1. «Фракционная перегонка» жидкого воздуха.
2. В лаборатории азот N2 получают при нагревании концентриро-ванного раствора нитрита аммония:

или разложением солей аммония:
![]()
Химические свойства азота
Хотя азот N2 один из наиболее электроотрицательных элемен-тов, он обладает сравнительно низкой реакционной способностью. Причина заключается в том, что его двухатомные молекулы неполярные, а тройная связь между двумя атомами азота в них обладает очень высокой прочностью. Энтальпия этой связи равна +944 кДж/моль.

При обычных условиях азот N2 реагирует только с литием, образуя нитрид:

С другими металлами реакция идёт только при нагревании:

Азот N2 взаимодействует с водородом и кислородом:

Нитриды металлов легко гидролизуются и взаимодействуют с кислотами:

Аммиак - NH3
Аммиак - NH3 – бесцветный газ с характерным резким запахом.
Получение NH3
1. В лаборатории NH3 получают, нагревая смесь хлористого аммония с гашёной известью.

2. Промышленный способ получения NH3 - синтезом из азота и водорода над катализатором (катализатор – железо).

Раствор аммиака в воде называют нашатырным спиртом.
![]()
![]()
Химические свойства аммиака NH3
В аммиаке NH3 азот достигает низшей степени окисления (-3), поэтому он обладает только восстановительными свойствами.
1. Аммиак NH3 сгорает в кислороде и в воздухе:

2. Взаимодействует с хлором и с бромом:

3. Взаимодействует с окисью меди (с помощью этой реакции получают азот в лаборатории):

Кислородные соединения азота.
Оксиды азота

Закись азота – оксид азота (I) – N2O
Оксид азота (I) N2O - бесцветный газ со слабым приятным сладковатым запахом.
Получается при разложении нитрата аммония:
![]()
При вдыхании паров N2O появляются признаки опьянения и нечувствительности к боли. Поэтому оксид N2O часто называют «веселящим» газом и применяют в медицине как анестезирующее средство (для наркоза!), однако в высоких концентрациях вызывает удушье!
Монооксид азота – оксид азота (П) - NO
Бесцветный газ, практически нерастворимый в воде. Обладает восстановительными свойствами и на воздухе приобретает бурую окраску (из-за образования диоксида азота).
1. Может быть получен при взаимодействии азота и кислорода:
![]()
Образование начинается при 15000. Хорошо образуется при 30000 – в атмосфере при грозовых разрядах.
2. В лаборатории:
![]()
Диоксид азота – оксид азота (IV) – NO2
Бурый ядовитый газ, имеет характерный запах, тяжелее воздуха, ядовит – раздражает дыхательные пути.
Получают:
1. Окислением оксида азота:
![]()
2. При прокаливании кристаллического нитрата свинца (П):
![]()
Азотистый ангидрид – оксид азота (Ш) – N2O3
Тёмно-синяя жидкость:
![]()
Азотистому ангидриду соответствует слабая азотистая кислота HNO2.
Азотный ангидрид – оксид азота (V) – N2O5
Твёрдое кристаллическое вещество, получается действием фосфорного ангидрида на азотную кислоту:
![]()
Азотистая кислота HNO2
2NO2 + H2O = HNO2 + HNO3
Соли получают в промышленности при взаимодействии оксидов азота и щёлочи.
![]()
Азотная кислота HNO3
В промышленности получают азотную кислоту тремя методами.
1. Из аммиака:
а) окисление аммиака на платиновом катализаторе:
![]()
б) окисление кислородом воздуха окиси азота:
в) поглощение NO2 водой в присутствии избытка кислорода:
![]()
2. Из воздуха («дуговой метод»).
Воздух сжигают при температуре 40000С. В качестве нагревателя использовано пламя электрической дуги.
3. Из селитры:
![]()
