
- •Оглавление
- •Задачи с решениями. Массовая доля компонента.
- •Молярная концентрация
- •Молярная концентрация эквивалента (нормальная концентрация)
- •Моляльная концентрация
- •Вопросы и задачи для самоподготовки.
- •Образец билета тестированного контроля
- •Лабораторная работа Приготовление раствора заданной концентрации разбавлением концентрированного раствора
- •Задачи с решениями.
- •Вопросы и задачи для самоподготовки.
- •Образец билета тестированного контроля по теме «Свойства растворов электролитов»
- •Водородный и гидроксильный показатели. Гидролиз солей.
- •Образец билета тестированного контроля
- •Задачи с решениями
- •Вопросы и задачи для самоподготовки.
- •Задачи с решениями.
- •Вопросы и задачи для самоподготовки
- •Образец билета тестированного контроля
- •Лабораторные работы
- •Задачи с решениями.
- •Образец билета тестированного контроля
- •Контрольная работа по разделам:
- •Образец билета контрольной работы
- •Образец билета тестированного контроля
- •Задачи с решениями
- •Вопросы и задачи для самоподготовки.
- •Лабораторные работы.
- •Вопросы и задачи для самоподготовки.
- •Образец билета тестированного контроля
- •Лабораторные работы
- •Экзаменационные вопросы.
- •Литература
- •1. Глинка н.Л. Общая химия. л.: Химия, 1986. 703 с.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ
ГОСУДАРСТВЕННОЕ УНИТАРНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
КАФЕДРА ОБЩЕЙ И ОРГАНИЧЕСКОЙ ХИМИИ
РУКОВОДСТВО
К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
ПО ОБЩЕЙ ХИМИИ
(часть I)
КАЗАНЬ 2006
ББК 24я73
К 24
Печатается по решению Центрального координационно-методического совета Казанского государственного медицинского университета
Составители:
ст.преподаватель кафедры общей и органической химии Галеева С.И.,
доцент кафедры общей и органической химии Ситдиков И.Б.,
доцент кафедры общей и органической химии Хисамеев Г. Г.,
ст.преподаватель кафедры общей и органической химии Сагдеев К.А.
Под редакцией д.х.н. Никитиной Л.Е.
Рецензенты:
доцент кафедры Технологии неорганических веществ КГТУ Порфирьева Р.Т., доцент кафедры общей химии КГАСУ
Бойчук В.А.
Руководство к практическим занятиям по общей химии (часть I)/Галеева С.И., Ситдиков И.Б., Хисамеев Г.Г., Сагдеев К.А. Под ред. Никитиной Л.Е. Казань: КГМУ, 2006. 102 с.
Учебное пособие составлено в соответствии с Государственным образовательным стандартом высшего и профессионального образования и программой преподавания общей химии. В пособии приведены краткое изложение теоретического материала, примеры решения задач, вопросы и задачи для самоподготовки, описание лабораторных работ и контрольно-измерительные материалы в виде тестов по различным темам.
Предназначено для студентов I курса лечебного, педиатрического, стоматологического и медико-профилактического факультетов КГМУ.
Казанский государственный медицинский университет, 2005
Оглавление
Занятие 1. Тема: Способы выражения концентрации растворов..….................4
Задачи с решениями……………………………………………………..….……....7
Вопросы и задачи для самоподготовки………………………………………....13
Лабораторная работа……………………………...……………………………...15
Занятие 2. Тема: Растворы сильных и слабых электролитов……....……….16
Задачи с решениями…………………………………………………………….18
Вопросы и задачи для самоподготовки………………………………………...20
Занятие 3. Тема: Автопротолиз воды. Ионное произведение воды.
Водородный и гидроксильный показатели. Гидролиз солей……………...23
Задачи с решениями…………………………………………………………...….25
Вопросы и задачи для самоподготовки……………………………….……...….27
Занятие 4. Тема: Буферные растворы. Гетерогенное равновесие.…………..30
Буферные растворы…………………………………………………………......30
Задачи с решениями……………………………………………………………....31
Вопросы и задачи для самоподготовки……………………………….………....33
Гетерогенное равновесие…………………………………………………….....34
Задачи с решениями…………………………………………………………..…..35
Вопросы и задачи для самоподготовки……………………………….………....36
Лабораторные работы……………………………..………………………….….38
Занятие 5. Тема: Коллигативные свойства растворов неэлектро-
литов………………………………………………………………………………...40
Задачи с решениями……………………………………………………………....42
Вопросы и задачи для самоподготовки……………………………….………...46
Занятие 6. Тема: Обобщение знаний по объёмному анализу. Контрольная работа по разделам «Учение о растворах», «Объёмный анализ». Образец билета контрольной работы…………………………………………………….....52
Занятие 7. Тема: Элементы химической термодинамики и биоэнергетики. Термохимия.……………………………………………………………………….52
Задачи с решениями……………………………………………………………...55
Вопросы и задачи для самоподготовки……………………………………..….57
Занятие 8. Тема: Химическая кинетика и катализ.……………………….….62
Задачи с решениями…………………………………………………………..….64
Вопросы и задачи для самоподготовки……………………………………..….67
Лабораторные работы……………..…………………………………………….70
Занятие 9. Тема: Химическое равновесие.………………..…………………….73
Задачи с решениями……………………………………………………………....75
Вопросы и задачи для самоподготовки……………………………….………....78
Лабораторные работы………………………………………………..…………..83
Экзаменационные вопросы…………………………………..………..………....85
Приложение………………………………………………..…………..………....91
Литература……………………………………………………………..…….….102
4
ЗАНЯТИЕ 1
Тема: Способы выражения концентрации растворов.
Под концентрацией раствора понимают содержание растворённого вещества (в г или моль) в единице массы или объёма раствора или растворителя.
Различают приближённые и точные способы. К приближённым относятся понятия разбавленный, концентрированный, ненасыщенный, насыщенный и пересыщенный растворы. К точным способам выражения концентрации относятся:
Массовая доля растворённого вещества (Х) представляет собой отноше-ние массы растворённого вещества (m(X)) к массе раствора (m(p-p)); это безразмерная величина, выражаемая в долях единицы, в сотых долях или процентах (%), в тысячных долях или промилле (%о), в миллионных долях или в млн1. Например, (Х) = 0,005 = 0,5% = 5 %о = 5000 млн1.
В медицинской литературе массовую долю принято выражать в грамм-процентах (г%) (равнозначно процентам), миллиграмм-процентах (мг% или 103 г%) и в микрограмм-процентах (мкг%или 106 г%). Таким образом, (Х) = 0,005 = 0,5% = 0,5 г% = 500 мг% = 500000 мкг%. Например, 5%-ный раствор это пятипроцентный раствор или раствор с массовой долей растворённого вещества, равной 5% или 0,05.
2. Молярная доля (X) представляет собой отношение количества вещества компонента раствора (Xi) к общему количеству всех компонентов (Xi), составляющих раствор. Это безразмерная величина, выражаемая в долях единицы или процентах.
3. Объёмная доля (X) представляет собой отношение объёма компонента раствора (жидкости) V(X) к общему объёму раствора (смеси жидкостей) V(р-р). И эта безразмерная величина может выражаться как в долях единицы, так и в процентах.
5
4. Молярная концентрация С(Х) представляет собой отношение количества вещества компонента раствора (X) к объёму раствора V(р-р); размерность моль/л. Например, 0,1 М раствор означает децимолярный раствор или раствор с молярной концентрацией растворённого вещества, равной 0,1 моль/л.
5. Молярная концентрация эквивалента
(или нормальная концентрация)![]() представляет собой отношение
количества вещества эквивалента в
растворе (
представляет собой отношение
количества вещества эквивалента в
растворе (![]() )
к объёму раствора; размерность
моль/л.
)
к объёму раствора; размерность
моль/л.
Понятие «эквивалент вещества» связано с конкретной реакцией, в которой вещество участвует. Эквивалент ( ) это условная или реальная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или одному электрону в данной окислительно-восста-новительной реакции. Эквивалент одноосновной кислоты или однокислотного основания это всегда реальная частица, молекула Х. В случае многоосновных кислот и многокислотных оснований эквивалентом может быть реальная молекула Х или её какая-то часть (доля) . Число, показывающее долю реальной частицы, эквивалентной одному иону водорода в реакциях кислотно-основного типа или одному электрону в окислительно-восстановительных реакциях, называется фактором эквивалентности (fэкв.(Х) или ).
Примеры определения эквивалентов различных веществ в различных реакциях приведены в таблицах 1 и 2 Приложения.
Если в химической реакции участвуют два вещества Х1 и Х2, то по закону эквивалентов количество эквивалента одного вещества ( 1) равно количеству эквивалента второго вещества ( 2), т.е.:
( 1) = ( 2).
6
Если кислотно-основная реакция протекает до конца, то при нахождении фактора эквивалентности кислот, оснований и солей следует учесть, что Z это основность кислоты или кислотность основания, а в случае солей произведение числа атомов металла, образующего соль, на его валентность.
Один
моль эквивалентов вещества Х содержит
число Авогадро частиц (6,02.1023
эквивалентов Х). Молярная масса вещества
эквивалента
![]() определяется произведением фактора
эквивалентности на молярную массу
вещества: М(
)
=
определяется произведением фактора
эквивалентности на молярную массу
вещества: М(
)
=
![]() .
.
Растворы с той или иной нормальной концентрацией С( )* растворённого вещества используются для вполне конкретных реакций. Например, 0,01 н раствор или сантинормальный раствор, раствор с нормальной концентрацией растворённого вещества, равной 0,01 моль/л; 0,001 N раствор или миллинормальный раствор.
6. Моляльность (моляльная концентрация) раствора в(Х) представляет собой отношение количества растворённого вещества v (X) к массе растворителя
m(р-тель); размерность моль/кг.
* допускаются следующие обозначения: нормальной концентрации N(Х) вместо С( ), моляльной концентрации Сm(Х) вместо в(Х).
7. Титр (или массовая концентрация) t(X) представляет собой отношение массы растворённого вещества к объёму раствора; размерность г/мл.
Формулы, позволяющие производить расчёт массовых, объёмных и молярных долей, титра, а также различных видов концентраций раствора приведены в таблице 3 Приложения.
По
закону эквивалентов, если взаимодействуют
растворы двух веществ V(p-р X1)
и V(p-p X2)
с нормальной концентрацией
![]() и
и![]() ,
cоответ-ственно и титром t(X1)
и t(X2)
, то:
,
cоответ-ственно и титром t(X1)
и t(X2)
, то:
7
 ;
; 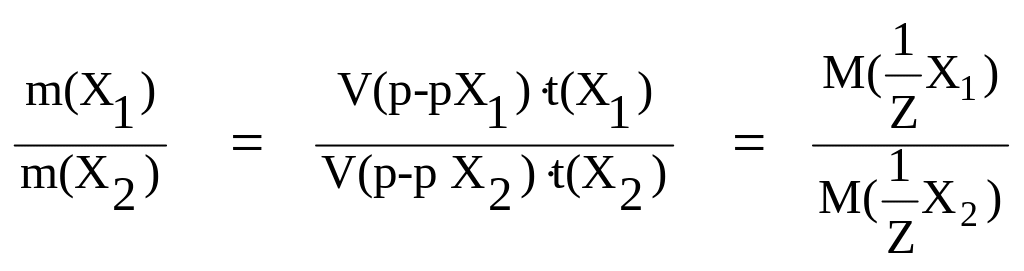 .
.
