
- •Общие методические указания.
- •Тематический план.
- •Методические указания по изучению тем курса и программы
- •Раздел 1. Неорганическая химия.
- •Тема 1.1. Основные понятия и законы химии.
- •Тема 1.2. Классификация химических реакций.
- •Тема 1.3. Основные классы неорганических соединений, их состав, строение, свойства.
- •Тема 1.4. Периодический закон и периодическая система химических элементов д.И. Менделеева и строение атома. Металлы. Неметаллы.
- •Тема 1.5. Теория электролитической диссоциации.
- •Тема 1.6. Реакции ионного обмена.
- •Раздел 2. Теоретические основы органической химии.
- •Тема 2.1. Основные понятия органической химии и теория строения органических соединений. Углеводороды.
- •Тема 2.2. Кислородосодержащие органические соединения.
- •Тема 2.3. Карбоновые кислоты.
- •Тема 2.4. Жиры.
- •Тема 2.5. Углеводы.
- •Раздел 3. Теоретические основы биохимических процессов.
- •Тема 3.1. Роль воды в организме. Водный обмен.
- •Тема 3.2. Витамины.
- •Тема 3.3. Гормоны и ферменты.
- •Тема 3.4. Обмен веществ в организме человека.
- •Тема 3.5. Обмен белков, жиров, углеводов.
- •Раздел 4. Теоретические основы аналитической химии.
- •Тема 4.1. Качественный анализ.
- •Тема 4.2. Методы количественного анализа.
- •Тема 4.3. Титриметрический метод анализа. Физико-химические методы анализа.
- •Раздел 5. Физическая и коллоидная химия.
- •Тема 5.1. Вступление. Основные понятия и законы термодинамики. Термохимия.
- •Тема 5.2. Агрегатные состояния вещества.
- •Методика решения задач.
- •Тема 5.3. Химическая кинетика и катализ. Химическое равновесие.
- •Тема 5.4. Свойства растворов.
- •Тема 5.5. Поверхностные явления. Адсорбция.
- •Тема 5.6. Коллоидные растворы.
- •Тема 5.7. Грубодисперсные системы.
- •Информационные источники
- •Перечень рекомендуемых учебных изданий,
- •Интернет-ресурсов, дополнительной литературы
- •Основные источники:
- •Дополнительные источники:
- •Интернет-ресурсы:
Тема 4.2. Методы количественного анализа.
Методы количественного анализа. Подготовка вещества к анализу, отбор средней пробы. Типы весовых определений. Операции весового анализа. Вычисления в весовом анализе. Применение гравиметрического метода в пищевой промышленности.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Количественный анализ – это раздел аналитической химии, описывающий методы, с помощью которых определяют количественный состав анализируемого вещества. Методами количественного анализа пользуются в санитарно-гигиенических лабораториях для анализа продуктов питания, питьевой воды.
Количественный анализ подразделяются на несколько методов:
- химический;
- физико-химический;
- физический.
В основе весового анализа лежит точное взвешивание на аналитических весах.
Весовой анализ включает несколько процессов:
- отбор средней пробы и подготовка вещества к анализу;
- взятие навески;
- ее растворимость;
- осаждение;
- проба на полноту осаждения;
- фильтрование и промывка осадка;
- высушивание или прокаливание осадка;
- вычисление результатов анализа.
Навеску вещества рассчитывают, исходя из трех типов гравиметрических определений:
- определяемую составную часть выделяют из вещества и взвешивают ее;
- определяемую составную часть удаляют и взвешивают остаток;
- определяемую составную часть превращают в соответствующее химическое соединение, которое выделяют и взвешивают.
Результаты измерений всегда отличаются от истинных значений измеряемых величин, поэтому они являются их приближенными оценками.
Разница между результатами измерений (Х изм.) и истинным значением (Х ист.) измеряемой величины называется абсолютной погрешностью измерений:
∆Х = Х изм. – Х ист.
Относительная погрешность измерений представляет собой отношение абсолютной погрешности измерения к истинному значению измеряемой величины и выражается, как правило, в процентах.
ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ ОБУЧАЮЩИЙСЯ ДОЛЖЕН ЗНАТЬ И УМЕТЬ:
- Сущность и методы количественного анализа.
- Весовой метод анализа.
- Выполнять основные операции весового анализа.
ВОПРОСЫ ДЛЯ КОНТРОЛЯ:
Перечислите методы количественного анализа. В чем их сущность?
В чем сущность весового анализа?
Какие операции производят при весовом анализе.
Тема 4.3. Титриметрический метод анализа. Физико-химические методы анализа.
Сущность титриметрического метода анализа. Методы определения эквивалентной точки. Способы выражения концентраций. Определение эквивалентных масс. Расчеты в титриметрическом методе анализа.
Метод нейтрализации. Сущность метода. Индикаторы. Рабочие растворы, их приготовление. Применение метода в анализе пищевых продуктов.
Физико-химические методы анализа.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Титриметрический (объемный анализ) – метод количественного анализа, где искомое вещество определяют по объему реактива с точно известной концентрацией, затраченной на реакцию с этим веществом. По сравнению с гравиметрическим, объемный анализ требует меньшей затраты времени, но уступает в точности. При определении объемным методом, к известному объему раствора определяемого вещества, малыми порциями (по каплям) добавляют реактив с точно известной концентрацией до тех пор, пока его количество не будет эквивалентно количеству определяемого вещества. Раствор реактива с точно известной концентрацией называют рабочим, стандартным или титрованным.
Основной операцией любого метода объемного анализа является титрование. Титрованием называют приливание одного раствора к другому с целью определения концентрации одного из них, если известна концентрация другого. При титровании необходимо соблюдать следующие условия:
- реакция между реагирующими веществами должна быть необратимой и проходить количественно до конца.
- конец реакции (точка эквивалента) должна четко фиксироваться каким-либо внешним признаком, это достигается с помощью индикатора.
- вещества, которые находятся в растворе вместе с определяемым не должны мешать течению основной реакции.
В объемном анализе различают:
- окислительно-восстановительный метод.
- метод осаждения и комплексообразования.
Пользуясь данными методами в лабораторной практике можно исследовать качество I, II блюд, закусок и т.д.
Формулы для вычислений в объемном анализе
Q
= T
* V;
или T
=
 ;
;
T
=
 ;
или H
=
;
или H
=
 .
.
Согласно закону эквивалентов на титрирование 1 г-экв любого вещества будет израсходовано 1 г-экв другого вещества. Из этого вытекает правило:
Объем двух растворов разных веществ (кислот и щелочей) реагирует между собой в количествах обратно пропорциональным их нормальностям.
 =
=
 или V1
=
или V1
=

Вычисления в объемном анализе
Условные обозначения
М – молекулярная масса
Э – эквивалент
V – объем раствора
Т – титр раствора
Н – нормальная концентрация
Q – количество определяемого вещества
г-экв – грамм-эквивалент
С г/л – количество грамм вещества в 1 литре.
В объемном анализе концентрацию веществ выражают числом эквивалента вещества, содержащегося в одном литре раствора, т.е. его нормальностью. обозначается буквой – Н.
Т – титр показывает, какое количество грамм вещества растворено в 1 мл. С точки зрения нормальности, растворы могут быть деценормальными и сантинормальными (0,1; 0,2 или 0,01; 0,02; 0,03). Эквивалент записывается буквой Э и рассчитывается по формуле:
Для кислот: Эк-т =
 ;
;
Например:
ЭH2SO4
=
 =
=
 = 49
= 49
Для оснований: Эосн. =
 ;
;
Например: ЭNaOH = 40
Для солей: Эсоли =
 ;
;
Например:
ЭAl2(SO4)3
=
 = 57
= 57
Между нормальностью и титром существует зависимость. Зная нормальность можно рассчитать титр и наоборот.
Т
=
 или Н =
или Н =

Растворы разной концентрации реагируют между собой в объемных количествах, обратно пропорционально их нормальности.
Q = T * V; T =
 =
=
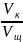 или
V1
* H1
= V2
* H2
или
V1
* H1
= V2
* H2
или
Нк
=

Vк
=

Зная объемы растворов и нормальность одного из них, пользуясь уравнением:
=
можно рассчитать нормальность другого вещества
Нщ
=
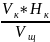 .
.
Задача:
Сколько граммов нитрата серебра потребуется для приготовления 1,5 л 0,1 Н раствора?
Решение:
Q = ? V = 1,5 л Н = 0,1 |
Q = T * V ЭAgNO3 = М = 170
T
=
;
T
=
Q = 0,017 * 1,5 = 0,0255 г. |
ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ ОБУЧАЮЩИЙСЯ ДОЛЖЕН ЗНАТЬ И УМЕТЬ:
- Сущность и разновидности объемного анализа, вычисления в объемном анализе.
- Метод нейтрализации, его сущность, индикаторы, рабочие растворы.
- Уметь определять титр, нормальность и количество вещества.
ВОПРОСЫ ДЛЯ КОНТРОЛЯ:
В чем сущность объемного анализа? Какие разновидности объемного анализа различают?
Перечислите, какие Вы знаете важнейшие условия для правильного проведения объемно-аналитических определений?
В чем сущность метода нейтрализации? Какая химическая реакция лежит в основе этого метода?
Что такое стандартный или титрованный раствор?
Вычислить титр 0,1096 Н раствора HCl (ответ: 0,0040 г/мл).
50 мл раствора H2SO4 неизвестной концентрации реагирует нацело с 45,6 мл 0,1 Н NaOH. Какова нормальность раствора?

 = 0,017 г/мл
= 0,017 г/мл