
БИЛЕТ 25
.docxБИЛЕТ 25
-
Принцип наилучшего использования энергии. Способы теплообмена и приёмы рационального использования энергии для снижения тепловых потерь. Регенерация теплоты. Проанализировать организацию энерготехнологической схемы производства азотной кислоты.
При организации ХТС энергетические проблемы имеют ресурсосберегающий, экологический и экономический характер.
Энергетические проблемы ХП включают в себя экономический аспект - энергетической проблемы связан с тем, что в себестоимости химической продукции доля энергии составляет до 60% от затрат на сырье. Поэтому одной из основных задача энергосберегающих технологий является снижение затрат энергии на единицу продукта и уменьшение тепловыделение в окружающую среду.
Способы рационального использования энергии:
- перевод производства на непрерывную технологию;
- использование топливного потенциала горючих отходов;
- создание агрегатов большой единичной мощности, позволяющих концентрировать энергию;
- рациональная организация энерготехнологических агрегатов.
Регенерация теплоты
Использование тепла отходящих продуктов реакции для нагрева входящих потоков. Для этой цели применяют три основных способа:
- непосредственный теплообмен (используется в тех случаях, когда теплообменивающиеся вещества находятся в разных фазах);
- теплопередача через теплообменную поверхность;
- перенос тепла при помощи тепловых агентов.
Рациональное проведение процесса при высоких температурах.
Многие процессы химической технологии проводятся при высоких температурах. Это весьма энергоемкие процессы, поэтому их энергетическому оформлению следует уделять наибольшее внимание.
а) Снижение тепловых потерь.
б) Подогрев газов, поступающих в контактный аппарат, теплом продуктов реакции.
в) Использование тепла для получения пара в котле-утилизаторе.
г) Рациональное оформление технологического процесса предполагает использование тепла отходящих газов для различных этапов данного процесса.
д) Регулирование нагрузки реактора.
Реализация принципа наилучшего использования энергии в производстве азотной кислоты:

-
Нитрозные газы при 890-910 °С поступают в котел-утилизатор 15, расположенный под контактным аппаратом. В котле за счет охлаждения нитрозных газов до 170 °С происходит испарение воды, питающей котел-утилизатор; при этом получают пар с давлением 1,5 МПа и температурой 230°С.
-
За счет реакции окисления нитрозные газы нагреваются до 300-335°С. Эта теплота используется в подогревателе воздуха 12. Охлажденные в теплообменнике 12 нитрозные газы поступают в теплообменник 11, где происходит снижение их температуры и нагрев выхлопных (хвостовых) газов.
-
Очищенные газы поступают в газовую турбину 17 при температуре 690-700°С; энергия, вырабатываемая турбиной за счет теплоты хвостовых газов, используется для привода турбокомпрессора 18 (Энергия рекуперируется в результате установки на одной оси с турбокомпрессором газовой турбины)
-
Производство серной кислоты. Основные стадии процесса. Возможные варианты получения сернистого ангидрида. Абсорбция SO3 . Выбор поглотителя и температуры процесса. Метод ДК-ДА. Технологическая схема производства серной кислоты из серы.

Основные стадии:
-
Получение сернистого ангидрида
(в качестве исходного сырья может быть:
-
самородная сера;
-
газовая сера;
-
железный (серный) колчедан – FeS2 ;
-
отходящие газы цветной металлургии;
-
газы переработки сульфатов металлов.)
S+O2=SO2
4FeS2+11O2=2Fe2O3+8SO2
-
Окисление сернистого ангидрида в серный ангидрид
SO2+0,5O2=SO3
-
Абсорбция серного ангидрида
SO3+H2O=H2SO4
абсорбция SO3:
SO3 + Н2О↔Н2SO4 ΔH < 0;
Реакция обратимая, экзотермическая.
Все современные схемы производства серной кислоты работают по методу ДК-ДА (двойное контактирование – двойная абсорбция), основанном на том, что после 3- его слоя катализатора газ выводится из контактного аппарата и после соответствующего охлаждения поступает на промежуточную абсорбцию SO3, после чего снова возвращается в контактный аппарат (на 4-ый катализаторный слой). Это позволяет благоприятно сместить равновесие процесса окисления, что приводит к увеличению выхода SO3. Кроме того повышается интенсивность процесса на 4-ом и 5-ом слоях катализатора.
В этих условиях конверсия SO2 в SO3 достигает 99,8 %.
Выбор абсорбента.В качестве поглотителя выбирается 98,3% серная кислота, азеотропная смесь, которая характеризуется минимальным парциальным давлением как паров воды, так и паров SO3.
Если взять кислоту меньшей концентрации, то над ней будет большее парциальное давление паров воды и возможно образование тумана, если использовать кислоту большей концентрации, то увеличивается парциальное давление паров SO3, и тем самым, падает движущая сила (Δ), что приведет к уменьшению полноты поглощения SO3.
Процесс абсорбции проводят таким образом, чтобы концентрация серной кислоты при однократном прохождении абсорбера повышалась лишь на 1-1,5 %.
Выбор температуры процесса. Абсорбция проводится при температуре примерно 40-50 С. При более низкой температуре возможно образование сернокислотного тумана.
3. Каталитический процесс получения продукта С протекает в газовой фазе и имеет следующую стехиометрию:
2А + В = C + Д
Термодинамические характеристики основной реакции имеют следующие величины: ΔНо = -70 кДж/моль, ΔSо = -120 Дж/моль·К. Катализатор работоспособен в диапазоне температур 380-420 ОС. Реагент В участвует в побочных реакциях.
Выберите условия процесса и предложите функциональную технологическую схему.
Напишите расчётные формулы для определения значений технологических критериев качества процесса для продукта С по каждому из реагентов.




310°C


Область работы катализатора (380-420°С)
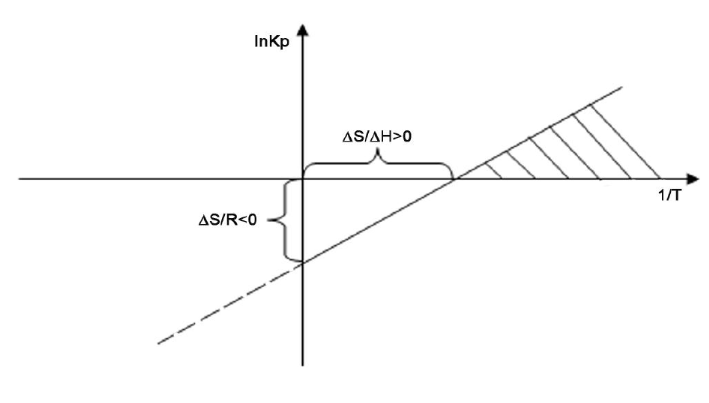
Следовательно, процесс обратимый и несмещенный. Необходим рецикл:





Расчетные формулы для определения технологических критериев качества процесса для продукта С по каждому из реагентов:
2А + В = C + Д
-
Конверсия


-
Выход


-
Селективность


-
Расходные коэффициенты
-
Теоретический


-
Практический


