
- •Письмова робота
- •4.Вказати молекулу, сумарний дипольний момент якої дорівнює нулю:
- •7. Серед наведених вказати найменш стійкий оксид:
- •Письмова робота
- •4.Вказати молекулу, сумарний дипольний момент якої дорівнює нулю:
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •13. Під нормальними умовами (н.У.) в хімії розуміють наступні числові значення тиску та температури:
- •17. Чим необхідно подіяти на хлоридну кислоту, щоб отримати з неї хлор?
- •18. Яка з нижчеприведених реакцій відноситься до реакцій диспропорціонування?
- •Письмова робота
- •11. Яка з нижчеприведених солей підлягає повному гідролізу в водному розчині?
- •15. Вкажіть, яку із солей називають подвійною:
- •19. Вкажіть молекулярну формулу ангідриду перманганатної кислоти
- •20. Вкажіть неелектроліт
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •19. Вкажіть молекулярну формулу ангідриду перманганатної кислоти
- •20. Вкажіть неелектроліт
- •Письмова робота
- •20. Під нормальними умовами (н.У.) в хімії розуміють наступні числові значення тиску та температури:
- •Письмова робота
- •Письмова робота
4.Вказати молекулу, сумарний дипольний момент якої дорівнює нулю:
А) HCl; Б) Н2О; В) H2S; Г) CO2; Д) СоCl2.
5.В комплексі Н2[SiF6] вказати ступінь окиснення, координаційне число, тип гібридизації орбіталей комплексоутворювача :
А) +4; 4; sp3; Б) +4; 6; sp3d2; В) +4; 6; d2sp3;
Г) +4; 4; sp3d2; Д) +4; 4; d2sp3.
6.В окисно-відновному перетворенні KMnO4 → MnSO4 вказати хімічний еквівалент (1/z · x) для KMnO4:
А) KMnO4; Б) ½ KMnO4; В) 1/3 KMnO4 ;
Г) ¼ KMnO4; Д) 1/5 KMnO4.
7.Серед наведених солей вказати змішану сіль:
А) CaCl2; Б) Ca(ClO)2; В) Ca(NO3)2; Г) Ca(ClO)Cl; Д) CaI2
8.Назвати самодовільний процес:
А) електроліз; Б) фотоліз; В) радіоліз;
Г) гідроліз білків; Д) синтез білків.
9.За однакових моляльностей електролітів вказати розчин електроліту з найбільшою іонною силою:
А) NaNO3; Б) NaCl; В) Na2SO4; Г) KNO3; Д) KCl
10.Значення рН шлункового секрету в нормі під час травлення:
А) 1-3; Б) 3-4; В) 4-5; Г) 5-6; Д) 6-7 ?
11.Вкажіть число протонів в р-3
A) 15 Б) 16 В) 17 Г) 18 Д) 31
12. Вкажіть молекулярну формулу продукту реакції між простими речовинами, утвореними елементами, які мають наступну будову зовнішнього енергетичного рівня : 3s23p1 та 3s23p5
A) BaO Б) NaI В) BeBr2 Г) LiCI Д) AICI3
13. Вкажіть галогенангідрид
A) AIOHCI2 Б) SnCI2 В) PbI2 Г) POCI3 Д) BiOCI
14. Вкажіть середню сіль
A) NaH2PO2 Б) NaH2PO3 В) K2HPO4 Г) Ca(H2PO4)2 Д) NH4H2PO4
15. Водний розчин натрій гідроксиду поступово доливають до водного розчину цинк хлориду доти, доки гідроксид натрію не виявиться у надлишку. Які візуальні зміни відбуваються:
A) Спочатку утворюється осад, який потім розчиняється
Б) Змінюється колір розчину В) Утворюється осад
Г) Виділяються пухирці газу Д) Змін не відбувається
16. Молекулярному рівнянню реакції між NaНСО3 та NaОН відповідає скорочене іонне рівняння:
A) СО32- + HOH = НСО3-+ OH-
Б) СО32- + 2H+ = CO2 + H2O
В) СО32-+ CO2 + H2O = 2НСО3-
Г) 2OH- + H2CO3 = СО32- + H2O
Д) НСО3- + OH- = СО32- + H2O
17. Яке із наведених йонних рівнянь відповідає взаємодії карбонатної кислоти з карбонатом амонію:
A) K+ + HCO3- = KHCO3
Б) K2CO3 + 2H+ + CO32- = 2K+ + 2HCO3-
В) CO32- + H2O + CO2 = 2HCO3-
Г) K+ + HCO32- = HCO32-
Д) CO2 + K+ = K2CO3
18. Від яких чинників залежить добуток розчинності малорозчинних електролітів:
A) Температури Б) Тиску В) Концентрації солі в розчині
Г) Наявності каталізатора Д) Від об’єму
19. Селен – типовий неметал, який знаходиться у VI групі головної підгрупі ПС. Яка валентність селену у молекулі селенатної кислоти?
A) IV Б) III В) VI Г) II Д) V
20. Хлор – елемент VII групи головної підгрупи ПС. Яка валентність оксигенутворюючого елементу у молекулі гіпохлоритної кислоти?
A) V Б) IV В) III Г) II Д) І
Письмова робота
Маса 11,2л газу при температурі 7,8оС і тиску 782мм рт. ст. дорівнює 14г. Обчислити масу такого ж об’єму газу за нормальних умов. Обчислити молярну масу газу.
Формалін, глюкоза, оцтова та молочна кислота мають однакові масові частки Карбону – 40,01%, Гідрогену – 6,66% та Оксигену – 53,33%. Молекулярні маси речовин дорівнюють відповідно 30, 180,60 і 90. Знайти їх молекулярні формули.
Написати молекулярні рівняння наступних перетворень: натрій хлорид → натрій сульфат → натрій гідроксид → натрій гексагідроксоалюмінат → алюміній сульфат → алюміній нітрат → алюміній оксид → натрій метаалюмінат → алюміній гідроксид.
Знайти масу речовини, що залишиться у надлишку при змішуванні розчинів, що містять 15г барій хлориду та 11г калій сульфату.
Що треба знати, щоб написати електронно-структурну формулу атома? Сформулювати принцип Паулі, принцип мінімума енергії, правило Клєчковського та правило Хунда.
Електронна формула зовнішнього та передостаннього електронних рівнів атомів така: 3s2 3p6 3d5 4s2; 4s2 4p6 4d5 5s2; 5s2 5p6 5d5 6s2. Назвати елементи. До якого електронного сімейства вони належать? Як змінюються окисні властивості оксидів цих елементів у вищому ступені окиснення?
Пояснити чому в молекулах Н2О та NH3 валентні кути Н – Е – Н дорівнюють відповідно 104,5 та 107,3о? Як і чому змінюється геометрія частинок при переході від NH3 до NH4+?
В яких молекулах дипольний момент більший за нуль: N2, O2, CH4, NF3, HCl? Чому?
Написати рівняння реакцій (не менше двох) утворення катіонних та аніонних комплексів. Назвати складові частини комплексних сполук та назвати їх.
Що таке параметр термодинамічної системи? Навести приклади інтенсивних та екстенсивних параметрів. Що таке термодинамічна функція стану? Яка основна властивість функції стану термодинамічної системи? Яка з функцій стану буде мати для заданої термодинамічної системи найбільше значення? Яку з двох величин ∆G чи ∆F частіше використовують для вивчення хімічних реакцій? Чому?
Який загальний порядок реакції NO + O3 = NO2 + O2, якщо кінетичне рівняння реакції таке: v = K[NO]∙[O3]. У скільки стадій відбувається ця реакція?
Які речовини виявляють тільки окисні або тільки відновні властивості, або ті і інші властивості: K2MnO4, KMnO4, Cr2O3, K2CrO4, K2S, K2SO3, NH3, MnO2, CO, HNO2, HNO3, HCl, H2O2, F2, Cl2?
Які реакції належать до окисно-відновних?
K2Cr2O7 + KI+ H2SO4 → K2SO4 +I2 + Cr2(SO4)3 + H2O;
(NH4)2Cr2O7
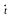 N2
+ Cr2
O3
+ H2O;
N2
+ Cr2
O3
+ H2O;
Cr2O3 + H2SO4 → Cr2(SO4)3 + H2O.
Скласти електронні рівняння і розставити коефіцієнти. Вказати окисник і відновник.
Охарактеризувати здатність металів до окисно-відновної взаємодії у водних розчинах у зв’язку з положенням їх у ряді напруг.
Закон розподілу Нернста.
Масова частка CaCl2 у розчині 20%. Знайти молярну та молярну концентрацію еквівалента c(
 CaCl2).
Густина розчину 1,18г/см3.
CaCl2).
Густина розчину 1,18г/см3.Обчислити рН сироватки крові, якщо концентрація іонів гідроксиду дорівнює 2,27∙10‾7моль/л.
Обчислити ступінь дисоціації і молярну концентрацію іонів гідрогену у розчині гідрогенфлуоридної кислоти з с(НF) = 0,3моль/л.
Варіант № 20
1.Що порядковий номер хімічного елементу в Періодичній системі дорівнює відносному заряду ядра атома елементу встановив:
А) Менделєєв; Б) Паулі; В) Мозлі; Г) Бор ?
2.Вказати число неспарених електронів у атомі 26Fe у нормальному стані:
А) 1; Б) 2; В) 3; Г) 4; Д) 5.
3.Вказати молекулу з пласкою структурою:
А) СО2; Б) СО; В) О=ССl2; Г) CH2Cl2; Д) CН3Cl.
4.Вказати молекулу, якій притаманно утворювати водневий звязок:
А) NH3; Б) H2S; В) HCl; Г) HBr; Д) HI.
5.В комплексі К4[Fе(С2О4)3] вказати ступінь окиснення, тип гібридизації орбіталей комплексоутворювача; дентантність лігандів :
А) +2; sp3d2; 2; Б) +2; d2sp3; 2; В) +2; sp3; 2;
Г) +2; d2sp3; 1; Д) +2; sp3d2; 1.
6.В окисно-відновному перетворенні Н2O2 → O2 вказати хімічний еквівалент (1/z · x) для Н2O2 :
А) Н2O2; Б) ½ Н2O2; В) 1/3 Н2O2;
Г) ¼ Н2O2; Д) 1/5 Н2O2.
7.Серед наведених вказати змішану сіль:
А) Ca3(РО4)2; Б) Ca(Н2РO4)2; В) Ca5(РO4)3F;
Г) Ca5(РO4)3ОН; Д) CaНРО4.
8.Якщо реакція анаболічна, то:
А) ∆U > 0; Б) ∆U < 0; В) ∆G > 0; Г) ∆H < 0; Д)∆H > 0.
9.За однакових моляльностей електролітів вказати розчин електроліту з найменшою іонною силою:
А) Na2SO4; Б) K2SO4; В) NaNO3; Г) CaCl2; Д) Ca(NO3)2.
10.Іонний добуток води при 25°С дорівнює:
А) 10-14 моль/л; Б) 10-14 моль2/л2; В) 10-10 моль/л;
Г) 10-10 моль2/л2; Д) 10-16 моль/л.
11. Деякі метали можуть реагувати з водою з утворенням гідроксидів та водню. Який гідроксид утворюється при взаємодії метала з водою?
A) LiOH; Б) Mn[OH]2; В) Fe[OH]3; Г) Zn[OH]2; Д) Cr[OH]3;
12. Яка з нижченаведених реакцій у розчині йде практично до кінця?
A) Сульфатна кислота+хлорид натрію
Б) Іодидна кислота+нітрат срібла
В) Хлорид калію+нітратна кислота Г) Хлорид натрію+гидроксид калію
Д) Сульфатна кислота+хлорид калію
13. Вкажіть ступінь окиснення комплексоутворювача в комплексному йоні [АuCI4]-
A) +2 Б) +3 В) +1 Г) 0 Д) -3
14. За нормальних умов 22,4 л це:
A) Об’єм 3,01·1023 молекул газу Б) Об’єм 9 г Н2О у вигляді пари
В) Об’єм 6,02·1023 молекул газу Г) Об’єм 22 г СО2 Д) Об’єм 34 г NH3
15. З якою з наступних речовин може реагувати оксид сульфуру [VI]?
A) HNO3 Б) NaCl В) Na2O Г) HCl
Д) Ні з одною з приведених речовин
16. Кислоти реагують з металами. Який газ виділяється при взаємодії заліза з концентрованою сульфатною кислотою?
A) SO3 Б) Н2S В) SO2 Г) Н2
Д) Ніякий газ не виділяється
17. Нітрит-іон проявляє токсичну дію, яку можна представити схемою:
![]() виконує
роль:
виконує
роль:
A) Окисника Б) Відновника В) Каталізатора
Г) Інгібітора Д) Середовища
18. Посиніння йодкрохмального папірця спостерігається при дії підкисленого розчину КMnO4 на розчин:
A) FeSO4 Б) HCl В) H2O2 Г) КІ Д) KNO2
19. Нітроген у різноманітних реакціях може віддавати та приймати електрони. В якій із вказаних реакцій нітроген проявляє властивості відновника?
A) N2 + 3F2 = 2NF3
Б) HNO3 + NaOH = NaNO3 + H2O
В) N2 + 3H2 = 2NH3
Г) HNO3 + 3HCl = 2Cl + NOCl + 2H2O
Д) Ba[NO3]2 = Ba[NO2]2 + O2
20. Вкажіть середню сіль
A) NH4H2PO4
Б) NaH2PO3
В) K2HPO4
Г) Ca(H2PO4)2
Д) NaH2PO2
