
семинар 1
.pdf
СЕМИНАР 1
Фазовое равновесие в однокомпонентных системах. Процессы испарения и возгонки
Прежде чем начать рассмотрение задач, необходимо познакомиться с таблицей, содержащей основные справочные материалы по данной теме. Это таблица 24 (стр. 30
– 35 справочника А.А. Равделя).
В ней приведены температуры фазовых превращений (испарения и возгонки) различных веществ при разных внешних давлениях. Под температурами возгонки можно увидеть пометку (кр.), то есть речь идет о кристаллическом веществе. Например, для брома:
1
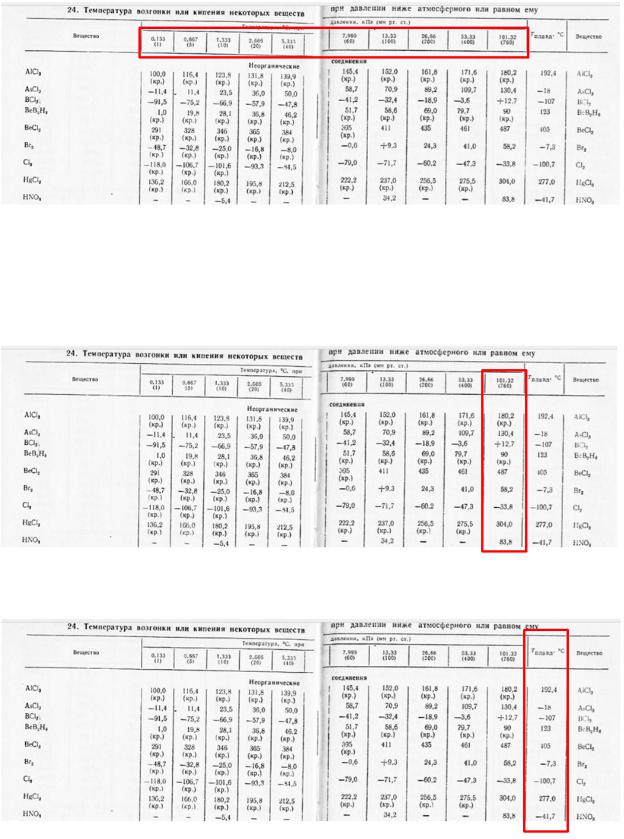
С другой стороны, из таблицы можно узнать давление насыщенного пара (в кПа или мм рт.ст.) над жидкой или твердой фазой при разных температурах:
Если по данным таблицы построить график в координатах |
− |
, то мы |
получим линии испарения и/или возгонки на фазовой диаграмме. |
|
Нормальные температуры кипения веществ находятся в крайнем правом столбце и соответствуют атмосферному давлению (101,32 кПа или 760 мм рт.ст.).
Последний столбец таблицы содержит температуры плавления.
И если температур возгонки и испарения для каждого вещества несколько, так как они зависят от давления, то температура плавления только одна (от давления практически не зависит, и ее можно относить к любому внешнему давлению).
2

Задача 3
В задаче требуется найти изменение энтропии и внутренней энергии при испарении вещества. Уравнение Клапейрона-Клаузиуса позволяет найти теплоту испарения. Поэтому, прежде чем вычислять другие термодинамические функции, сначала необходимо найти ∆исп .
Так как в условии сказано, что «теплоту испарения в интервале температур можно считать постоянной», то тепловой эффект ищем именно средний, используя интегральную форму уравнения Клапейрона-Клаузиуса:
= ∆исп 1 − 1
или
∆исп = −
Для использования этой формулы необходимы две пары данных (давления насыщенного пара жидкости при двух разных температурах). В условии явно нет этих значений, но есть отсылка к справочным данным. Поэтому давления и температуры мы будем брать из таблицы 24, стр. 30 (справочник А.А. Равделя). Кроме того, в условии задан приблизительный температурный интервал температур, на который мы должны ориентироваться для выбора данных из справочника. Наиболее близкие температуры в справочнике (и
соответствующие им давления):
= 26 ( |
= 26 + 273 = 299 К) |
= 60 мм рт. ст. |
= 34,9 ( |
= 34,9 + 273 = 307,9 К) |
= 100 мм рт. ст. |
Именно их мы и подставим в расчетную формулу (не забывая переводить
температуру в Кельвины): |
100 |
|
Дж |
|
∆исп = |
8,314 ∙ 307,9 ∙ 299 |
= 43931,25 |
||
307,9 − 299 |
60 |
моль |
||
На следующем этапе рассчитаем изменение энтропии при заданной указанной температуре 27 :
3

∆исп = ∆исп исп
исп = 27 исп = 27 + 273 = 300 К
Подставляем значения: |
43931,25 |
|
Дж |
|
∆исп = |
= 146,44 |
|||
300 |
моль ∙ К |
Это изменение энтропии при испарении 1 моль вещества. В условии задано другое количество, а именно 1,5 моль. Учитываем это:
∆исп = 146,44 ∙ 1,5 = , |
Дж |
К |
Для расчета внутренней энергии испарения воспользуемся формулой связи изобарного и изохорного тепловых эффектов:
∆исп |
= ∆исп |
+ ∆исп |
∆исп |
= ∆исп |
− ∆исп |
|
∆исп |
= 1 |
∆исп = 43931,25 − 1 ∙ 8,314 ∙ 300 = 41437,05 Дж/моль
Учтём количество вещества: |
, Дж |
∆исп = 1,5 ∙ 41437,05 = |
Внимание! Для обратных фазовых переходов абсолютные значения термодинамических функций остаются такими же, но знак меняется на
противоположный. Например, для конденсации:
∆конд = −∆исп
∆конд = −∆исп
∆конд = −∆исп
∆конд = −∆исп = −1
Задачи для самостоятельного решения: № 1, 2, 4, 5, 6, 7
4

Задача 8
В данной задаче требуется найти теплоту испарения при заданной температуре, т.е. истинный тепловой эффект. В основе расчета лежит дифференциальная форма уравнения Клапейрона-Клаузиуса:
= ∆исп
откуда можно выразить тепловой эффект:
∆исп = |
|
∙ |
|
Вид уравнения аналогичен виду дифференциальной формы уравнения
изобары Вант-Гоффа. И нахождение истинной теплоты испарения проводится по той же схеме, что и расчет истинного теплового эффекта реакции, а именно:
, |
производная по |
|
|
|
|
|
|
|
|
|
|
|
|
∙ |
→ ∆исп = ( ) |
|
|
|
Вусловии дана функциональная зависимость:
=− 3308 + 10,373 − 0,8 ∙
Действуем по предложенной схеме:
2,303 ∙ = −2,303 ∙ 3308 + 2,303 ∙ 10,373 − 2,303 ∙ 0,8 ∙
=−2,303 ∙ 3308 + 2,303 ∙ 10,373 − 0,8 ∙
=+2,303 ∙ 3308 + 0 − 0,8
5

|
|
|
∙ |
= ∆исп = 2,303 ∙ 3308 ∙ − 0,8 ∙ ∙ |
Дж |
|
|
|
|
||||
∆исп |
К = 2,303 ∙ 3308 ∙ 8,314 − 0,8 ∙ 8,314 ∙ 630 = 59148,5 |
|||||
моль |
||||||
Учитываем количество вещества:
∆исп |
К (на 2 моль) = 59148,5 ∙ 2 = |
Дж |
Расчет энтропии проводится аналогично расчету в задаче 3:
∆исп = ∆исп исп
∆исп = |
118297 |
= |
, |
Дж |
630 |
К |
Задачи для самостоятельного решения: № 9, 10.
6

Задача 11
В этой задаче также требуется найти энтальпию (теплоту) испарения вещества при определенной температуре, т.е. истинный тепловой эффект. Используем дифференциальную форму уравнения Клапейрона-Клаузиуса:
|
|
|
|
= |
∆исп |
|
= |
|
||||
|
|
|
|
|
||||||||
Однако, так как зависимость в условии дана в виде функции |
, |
|||||||||||
перепишем уравнение в следующем виде: |
|
|
|
( ) |
||||||||
|
|
|
= |
∆исп |
|
∙ |
|
|
||||
|
|
|
|
|
||||||||
Выразим отсюда теплоту испарения: |
|
|
|
|
|
|||||||
∆исп = |
|
∙ |
|
|
|
|
||||||
|
|
|
|
|||||||||
Для того, чтобы найти значение производной , продифференцируем по
температуре данную в условии зависимость:
= 0 − 3,37 ∙ 10 − 2 ∙ 80,11 ∙
Подставим значение температуры:
=−10
=−10 + 273 = 263 К
|
|
К = 0 − 3,37 ∙ 10 |
|
− 2 ∙ 80,11 |
∙ 263 = 0,84 ∙ 10 |
Па |
||||||
|
|
|
К |
|||||||||
Для применения уравнения |
|
исп |
|
|
|
|
нам потребуется значение |
|||||
|
|
|
|
|
||||||||
давления. Имеется ввиду значение∆ |
|
|
|
|
|
|
|
|||||
давления при заданной температуре. Его |
||||||||||||
|
= ∙ |
|
|
( ): |
|
|||||||
можно найти, подстановкой |
в исходную зависимость = |
|
||||||||||
|
|
= 3,58 ∙ 10 |
− 3,37 ∙ 10 |
− 80,11 ∙ |
= 2,6 ∙ 10 Па |
|||||||
|
К = 3,58 ∙ 10 |
− 3,37 ∙ 10 |
∙ 263 − 80,11 ∙ 263 |
|||||||||
Теперь можно найти теплоту испарения:
7

∆исп = 0,84 ∙ 10 ∙ |
8,314 ∙ 263 |
= |
Дж |
2,6 ∙ 10 |
моль |
В условии не упоминается количество вещества, поэтому рассчитываем изменение энтальпии на 1 моль.
Задача для самостоятельного решения: № 12.
Задача 17
В условии даны две зависимости: первая представляет собой зависимость
давления насыщенного пара над твердой фазой от температуры: |
|
|||||||||
|
|
|
|
тв |
|
|
3160 |
|
|
|
а вторая – зависимость |
давления насыщенного пара над жидкой фазой |
от |
||||||||
|
= 12,486 − |
|
|
(1) |
||||||
температуры: |
|
|
|
ж = 7,884 − |
1860 |
|
(2). |
|
||
|
|
|
|
|
|
|||||
В то же время, эти уравнения описывают линейные зависимости в |
||||||||||
координатах |
− |
|
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Уравнение (1) описывает линию возгонки ОВ, уравнение (2) – линию испарения ОА. (Данные в условии зависимости включают в себя десятичный логарифм, но он может быть преобразован в натуральный домножением на 2,303, и вид графика от этого не изменится.)
8

Тройная точка О является точкой пересечения описываемых кривых.
Поэтому для нахождения ее координат надо решить систему уравнений для общих значений и , соответствующих давлению и температуре тройной точки:
т.т. = 12,486 − 3160
|
|
|
т.т. |
|
т.т. |
= 7,884 − |
1860 |
|
|
т.т. |
12,486 − 3160 = 7,884 − 1860
т.т. т.т.
1300 |
= 4,602 |
|
|||
|
|
т.т. |
|
||
т.т. = |
1300 |
= |
, К |
||
4,602 |
|||||
Подставляем найденное значение температуры в одно из уравнений и находим значение давления:
т.т. = 12,486 − |
3160 |
|
= 12,486 − |
3160 |
= 1,3 |
т.т. |
|
282,5 |
|||
т.т. = 10 , = |
мм рт. ст. |
|
|||
Для нахождения теплоты плавления вспомним связь между тепловыми эффектами фазовых переходов: испарения, плавления и возгонки:
9

∆возг = ∆исп + ∆пл
Отсюда теплота плавления:
∆пл = ∆возг − ∆исп
Теплоты испарения и возгонки можно найти из уравнений (1) и (2), сопоставив их с уравнением линейной зависимости, которое в общем виде записывается следующим образом:
|
|
= − ∆ф.п. |
∙ 1 + |
|
|
|
|
|
тв = 12,486 − 3160 |
|
− ∆ |
возг |
= − 2,303 ∙ 3160 |
||
возгонка |
тв = 2,303 ∙ 12,486 − 2,303 ∙ 3160 |
|
|||||
|
тв = |
− ∆возг ∙ 1 |
|
∆возг |
= 2,303 ∙ 3160 ∙ |
||
|
ж = 7,884 − 1860 |
|
− ∆ |
исп |
= − − 2,303 ∙ 1860 |
||
испарение |
ж = 2,303 ∙ 7,884 − 2,303 ∙ 1860 |
|
|
||||
|
ж = |
− ∆исп ∙ 1 |
|
∆исп |
= 2,303 ∙ 1860 ∙ |
||
∆возг |
= 2,303 ∙ 3160 ∙ = 2,303 ∙ 3160 ∙ 8,314 = 60426 |
Дж |
|
моль |
|||
∆исп |
= 2,303 ∙ 1860 ∙ = 2,303 ∙ 1860 ∙ 8,314 = 35567 |
Дж |
|
моль |
|||
|
∆пл = 60426 − 35567 = |
Дж |
|
|
моль |
|
|
Теперь, зная теплоту плавления, можно найти энтропию плавления:
∆пл |
= |
∆пл |
= |
∆пл |
|||
|
пл |
т.т. |
|
||||
∆пл = |
24859 |
= |
|
Дж |
|||
282,5 |
|
|
моль ∙ К |
||||
Задачи для самостоятельного решения: № 16, 18.
10
