
методичка
.pdf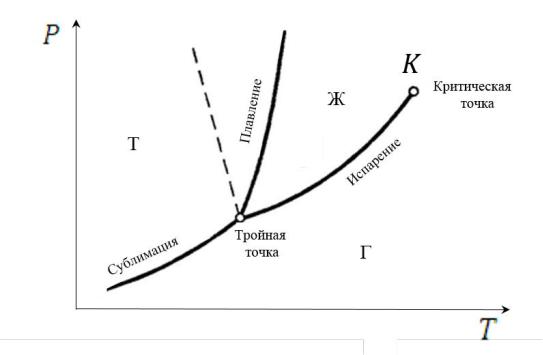
ФАЗОВОЕ РАВНОВЕСИЕ В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ
Основные понятия
Фазой называется совокупность всех гомогенных частей системы,
одинаковых во всех точках по составу и по всем физико-химическим свойствам и ограниченных от других частей видимой границей раздела. В
однокомпонентных системах отдельные фазы представляют собой одно и то же вещество в различных агрегатных состояниях.
Возможное число и характер фаз при выбранных условиях позволяет определить диаграмма состояния однокомпонентной системы
(р-Т-диаграмма):
Рис. 5. Диаграмма состояния однокомпонентной системы (т – твёрдое состояние; ж – жидкость; г – газ)
Если вещество может давать различные кристаллические
модификации, то каждая модификация является особой фазой. Так, сера
29
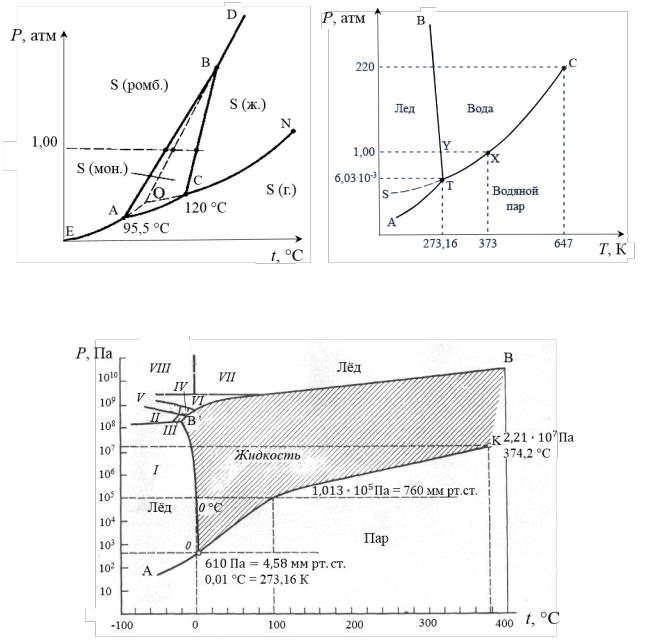
кристаллизуется в форме ромбической и моноклинной (рис. 6), вода образует несколько различных модификаций льда (рис. 7 и 8.) и т.д.
Каждая из перечисленных модификаций является устойчивой в определённых интервалах температуры и давления.
Рис. 6. Фазовая диаграмма серы |
Рис. 7. Фазовая диаграмма воды |
Рис. 8. Фазовая диаграмма воды в широкой области давлений
В гетерогенных системах числа компонентов и фаз связаны между
собой соотношением, получившим название правила фаз Гиббса:
= − Ф + ,
30

где – число степеней свободы, – число компонентов, Ф – число фаз,
– число внешних параметров, влияющих на фазовое состояние системы.
Под степенью свободы понимают возможность изменения какого-
либо свойства определённого состояния системы без изменения числа и природы фаз, т.е. число степеней свободы – это число независимых параметров, описывающих состояние системы, которые можно менять независимо друг от друга, без изменения числа и природы фаз.
Линии на фазовой диаграмме однокомпонентной системы описываются уравнением Клапейрона:
|
d |
= |
|
∆ф.п. |
|
, |
||
|
d |
|
|
∙ ∆ |
ф.п. |
|
||
|
|
|
|
ф.п. |
|
|
|
|
где ∆ф.п. – тепловой эффект |
фазового |
перехода, ф.п. – температура |
||||||
фазового перехода, ∆ф.п. – изменение объёма в ходе фазового перехода.
Для процессов испарения и возгонки (с учётом ряда допущений)
данное уравнение может быть представлено в виде:
dln = ∆ф.п. d 2
Данная форма уравнения называется уравнением Клапейрона–
Клаузиуса.
Это уравнение даёт возможность определить тепловой эффект фазового перехода (в данном случае – испарения или возгонки) на основании экспериментальных данных о зависимости давления насыщенного пара (жидкой или твёрдой фаз) от температуры.
Расчёт тепловых эффектов фазовых превращений
1. Расчёт среднего теплового эффекта испарения или возгонки
Расчёт проводится на основании интегральной формы уравнения Клапейрона–Клаузиуса при условии ∆ф.п. = :
31
dln = ∆ф.п. d 2
а) Аналитический расчёт
ln |
2 |
= |
∆ф.п. |
∙ ( |
1 |
|
− |
|
1 |
) |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||
|
1 |
|
|
1 |
|
|
2 |
|
|||
|
∆ф.п. = |
2 1 |
ln |
2 |
|
||||||
|
|
1 |
|||||||||
|
|
|
|
2 − 1 |
|
||||||
Таким образом, можно приближённо рассчитать среднюю теплоту испарения (возгонки), если известны хотя бы два равновесных давления пара при двух температурах.
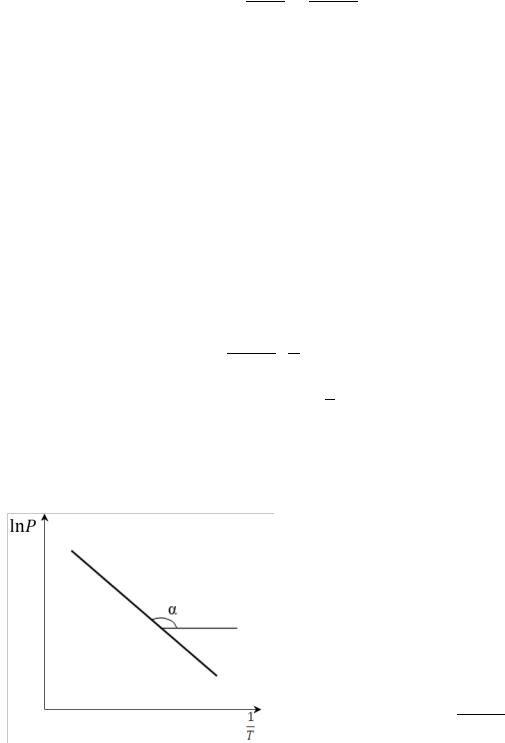
б) Графический расчёт
ln = − ∆ф.п. ∙ 1 +
Зависимость в координатах ln − 1 является линейной (рис. 9), и по тангенсу угла наклона прямой можно определить среднюю энтальпию испарения или возгонки:
Рис. 9. Графическое определение средней
теплоты испарения (возгонки) по
зависимости логарифма давления
насыщенного пара от обратной
температуры
tgα = − ∆ф.п.
2. Расчёт истинного теплового эффекта испарения или возгонки
Истинным называется тепловой эффект фазового превращения при заданной температуре. Расчёт проводится на основании дифференциальных форм уравнения Клапейрона–Клаузиуса.
32
а) Аналитический расчёт
Аналитический расчёт возможен, если имеется функциональная зависимость вида ln = ( ) или lg = ( ):
ln (lg ) = ( ) |
→ |
dln |
= |
∆ф.п. |
→ ∆ф.п. = |
dln |
∙ 2 |
|
d |
2 |
d |
||||||
|
|
|
|
|
или функциональная зависимость вида = ( ):
= ( ) |
→ |
d |
= |
∆ф.п. |
∙ → ∆ф.п. = |
d |
∙ |
2 |
|
d |
2 |
d |
|
||||||
|
|
|
|
|
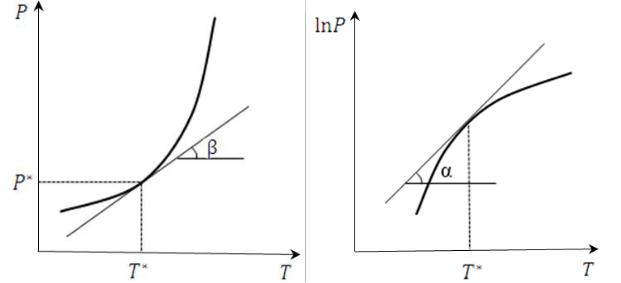
б) Графический расчёт Графический расчёт проводится по зависимостям вида = ( ) или
ln = ( ) (рис. 10 и 11).
Рис. 10. Графическое определение |
Рис. 11. Графическое определение |
|||||
истинной теплоты испарения (возгонки) |
истинной |
теплоты |
испарения |
|||
по зависимости давления насыщенного |
(возгонки) |
по |
зависимости |
|||
пара от температуры |
логарифма давления насыщенного |
|||||
|
|
|
пара от температуры |
|
||
∆ф.п. = tgβ ∙ |
2 |
|
∆ф.п. = tgα ∙ ∙ 2 |
|||
|
||||||
|
|
|
|
|||
33

3. Расчёт теплоты испарения по Правилу Трутона
Теплоты испарения различных жидкостей закономерно связаны с их нормальными температурами кипения.
Существует эмпирическое правило, которое носит название правила Трутона: Мольные энтропии испарения неполярных неассоциированных жидкостей при нормальной температуре кипения ( НТК) примерно одинаковы и в среднем составляют:
∆исп = |
∆исп |
= (88 ÷ 92) |
Дж |
|
≈ 89,12 |
Дж |
|
НТК |
моль ∙ К |
моль ∙ К |
|||||
|
|
|
|||||
Это правило выполняется только для неполярных,
неассоциированных в паровой фазе жидкостей и только при нормальной температуре кипения, которая у каждого вещества своя единственная.
Правило позволяет оценить величину теплоты испарения при нормальной температуре кипения:
∆исп = 89,12 ∙ НТК
4. Расчёт тепловых эффектов процессов плавления и полиморфных
превращений
В основе расчёта – уравнение Клапейрона:
d = ∆ф.п. d ф.п.∆ф.п.
а) Аналитический расчёт проводится по известной зависимости температуры плавления от давления:
= ( ) |
|
d |
|
|
d |
−1 |
|
→ |
|
→ |
∆ф.п. = ф.п. ∙ ∆ф.п. ∙ ( |
|
) . |
||
d |
d |
||||||
|
|
|
|
|
|||
Подставляя в |
полученное |
выражение необходимые значения |
|||||
давления и температуры, находим теплоту плавления.
34
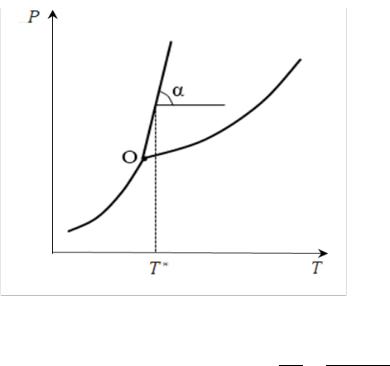
б) Графический расчёт:
Рис. 12. Графическое определение
теплоты плавления
По наклону линии плавления
tgα = d = ∆пл .
d пл∆пл
Отсюда выражаем теплоту плавления:
∆пл = пл ∙ ∆пл ∙ tgα
Подставляя в полученное выражение значение температуры и тангенса угла наклона линии плавления, получаем значение теплоты плавления.
Связь энтальпий испарения, плавления и возгонки в тройной точке
Теплоты (энтальпии) испарения, возгонки и плавления в тройной точке связаны между собой простым соотношением.
Представим переход вещества из твёрдого состояния в пар при условиях тройной точки двумя путями (рис. 13):
1)непосредственно путём возгонки;
2)первоначальное плавление, переход из твердого состояния в жидкое с последующим испарением жидкой фазы.
35
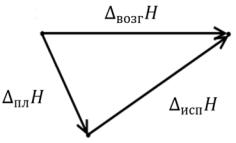
Твёрдая фаза |
Пар |
Жидкость
Рис. 13. Схема перехода вещества из твёрдого состояния
в пар при условиях тройной точки двумя путями
Из рис.13 видно, что теплота возгонки равна сумме теплот испарения и плавления:
∆возг = ∆исп + ∆пл
Очевидно, что ∆возг > ∆исп , а теплоту плавления можно найти,
зная теплоты возгонки и испарения (по их разности):
∆пл = ∆возг − ∆исп .
ЗАДАЧИ
1.Давление насыщенного пара над жидкой уксусной кислотой при
383 К равно 583 мм рт. ст., а при 403 К – 1040 мм рт. ст. Рассчитайте среднюю теплоту испарения и нормальную температуру кипения уксусной кислоты.
Ответ: 37,14 кДж/моль; 392 К.
2.Пользуясь справочными данными, рассчитайте среднее изменение энтальпии и внутренней энергии при испарении двух молей ацетона при 30 °С. Теплоту испарения в интервале 22÷40 °С считать постоянной.
Ответ: 63,39 кДж; 58,36 кДж.
3.Пользуясь справочными данными, рассчитайте среднее изменение
36

энтропии и внутренней энергии при испарении 1,5 моль этанола при
27 °С. Теплоту испарения в интервале 25÷30 °С считать постоянной.
Ответ: 218,66 Дж/К; 62,15 кДж.
4. Пользуясь справочными данными, рассчитайте температурный
d
коэффициент давления насыщенного пара d над жидким бензолом
при 60,6 °С. Теплоту испарения в интервале 40÷80 °С считать постоянной.
Ответ: 1878,65 Па/К.
5.Определить температуру кипения хлорбензола при 600 мм. рт. ст.,
если его нормальная температура кипения 405,4 К, а под давлением
400 мм. рт. ст. он кипит при 382,2 К. Вычислить изменения энтропии и внутренней энергии при испарении 1 моль хлорбензола при
нормальной температуре кипения.
Ответ: 396,5 К; 87,91 Дж/К; 32,27 кДж.
6.Пользуясь справочными данными, рассчитайте изменение энтропии при возгонке 2 моль антрацена C14H10 в интервале 145÷200 °С при средней температуре 185 °С.
Ответ: 379,44 Дж/К.
7.Давление насыщенного пара кристаллического CO2 при температуре
173 К равно 100 мм рт. ст., а при 180 К оно составляет 200 мм рт. ст.
Рассчитайте теплоту возгонки CO2 и давление насыщенного пара при
178 К.
Ответ: 24,89 кДж/моль; 166 мм рт. ст.
37

8.Давление насыщенного пара ртути (мм рт. ст.) можно выразить
уравнением: |
|
|
|
lg = − |
3308 |
+ 10,373 − 0,8 ∙ lg . |
|
|
|
||
|
|||
Определите энтальпию и энтропию испарения 2 моль ртути при нормальной температуре кипения (630 К).
Ответ: 118,14 кДж; 187,51 Дж/К.
9.Зависимость давления (Па) насыщенного пара от температуры для фреона CCl2F2 выражается уравнением:
lg = 34,5 − 2406,1 − 9,1 ∙ lg + 0,0037 ∙ .
Определите давление насыщенного пара, теплоту испарения,
изменение энтропии при испарении 1 моля фреона при 298 К.
Ответ:103055 Па; 29,75 кДж; 99,8 Дж/К.
10. Температурная зависимость давления насыщенного пара над жидким бромом (мм рт. ст.) выражается уравнением:
lg = − |
2210 |
− 4,8 ∙ lg . |
|
Определите энтальпию и энтропию испарения 1,5 моль брома при
331 К.
Ответ: 43,65 кДж; 131,78 Дж/К.
11.Рассчитайте энтальпию испарения хлора при –10 °С, если зависимость давления насыщенного пара над жидким хлором (Па) от температуры (К) описывается уравнением:
= 3,58 ∙ 106 − 3,37 ∙ 104 − 80,11 ∙ 2.
Ответ: 18,58 кДж/моль.
38
