
Министерство науки и высшего образования РФ

Российский химико-технологический университет имени Д.И.Менделеева
Институт химии и проблем устойчивого развития
Кафедра ЮНЕСКО «Зеленая химия для устойчивого развития»
Направление подготовки 05.03.06 Экология и природопользование
Курсовая работа
по дисциплине
«Основы природопользования»
КИСЛОРОД
|
Работу проверила |
|
|
к.х.н., доц. |
Додонова А.А. |
|
|
|
|
|
|
|
|
|
|
Работу выполнил (а) |
|
|
студент(ка) |
Новикова П. М. |
Содержание
Введение…………………………………………………………………………….3
1. История открытия кислорода……………………………………………………5
2.Распространенность в природе…………………………………………………..7
3.Получение…………………………………………………………………………8
4.Свойства кислорода
4.1 Физические свойства………………………………………………………10
4.2 Химические свойства……………………………………………………...11
5.Озон……………………………………………………………………………....12
6.Применение кислорода…………………………………………………………14
7.Биологическая роль кислорода……………………………………………..….16
8.Токсичность кислорода…………………………………………………..…….17
9. Экологические проблемы…………………………………………………..…18
Заключение………………………………………………..……………………..20
Приложения……………………………………………………………………….21
Список литературы………………………………………………..………….......24
Введение
Кислород
–
элемент 16-й
группы,
второго периода периодической
системы химических элементов Д.
И. Менделеева,
с атомным
номером 8.
(Рисунок 1)
Рис.1.Кислород в таблице Менделеева
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Обозначается символом О (от лат. Oxygenium). Кислород – газ без цвета, вкуса и запаха, немного тяжелее воздуха.
Благодаря тому, что кислород является самым активным неметаллом после фтора и другим его свойствам, он является очень важным для всех живых существ веществом, а также одним из самых противоречивых элементов.
Кислород – эликсир жизни: человеческое тело устроено так, что кислород может поступать ко всем 15 миллионам миллионов клеток, если мы перестанем его вдыхать, то через несколько минут умрем. Но в то же время кислород – огнеопасное вещество и смертельный яд, который нас убивает. [1]
Кислород необходим для существования почти любых живых организмов, имеет лекарственные свойства и помогает выживать космонавтам в чужой атмосфере и дышать аквалангистам. Но необходимо обратить внимание на то, что почти все соединения, так или иначе послужившие возникновению экологических проблем в нашем мире, являются кислородосодержащими.
-
История открытия кислорода
История изучения и открытия этого элемента является спорной. Первенство в открытии кислорода приписывают английскому священнику и химику Джозефу Пристли, шведскому аптекарю Карлу Шееле или сборщику налогов и создателю современной химии Антуану Лавуазье.
Шееле был первым из трех, но шесть лет ждал, что опубликовать результаты. Пристли получил кислород в 1774, пропуская сфокусированный луч света через оксид ртути и написал на эту тему три трактата. Оба отметили, что в чистом кислороде горение происходит активнее (Шееле, например, назвал кислород «огненным воздухом»), однако и Шееле и Пристли изначально воспринимали горение неверно, полагая, что при горении не расходуется кислород, а выделяется невидимое вещество – «флогистон». Они воспринимали кислород, как чистый воздух без примеси флогистона. [см. Приложение 1]
Революционер в химии Лавуазье разрушил эту идею и «флогистонную теорию», тормозившую развитие химии, в целом. Лавуазье дал новому газу название «кислород» и окончательно доказал, что именно он является активным компонентом воздуха: он заявил, что горение является не чем иным, как реакций между кислородом и другими веществами. В своем эксперименте он доказал, что алмазы Священной Римской империи испаряются при нагревании в присутствии кислорода, но в бескислородной среде устойчивы к нагреванию. На этом в своих экспериментах Лавуазье не остановился и при помощи своих сверхчувствительных весов показал, что дыхание человека и горение – это по сути одни и тот же процесс: в обоих случаях происходит реакция между кислородом и веществами. [2]
Но намного более интересным является тот факт, что алхимики не только обнаружили кислород намного раньше, но и имели четкое представление о его значении. В 1604 году польский алхимик Михаил Сендивогий писал: «Человек возник на земле и живет на ней благодаря воздуху; в воздухе есть тайная пища для жизни». Он предположил, что эта «тайная пища для жизни» циркулирует между воздухом и землей в виде необычной соли – селитры: при температуре выше 336℃ селитра разлагается, высвобождая кислород, который алхимики называли воздушной селитрой. Сендивогий считал, что обнаружил Эликсир Жизни, «без которого ни один смертный не может жить и ничто в мире не растет и не производится». Так же возможно, что Сендивогий научился получать кислород из селитры. [3]
Дальше всех своих современников в исследованиях кислорода продвинулся член Лондонского королевского общества Джон Мейоу. Он показал, что красный цвет крови объясняется тем, что при дыхании в легкие попадает воздушная селитра(кислород). Он считал, что воздушная селитра является составляющей воздуха, из которой она «становится пищей для огня, а также попадает в кровь животных при дыхании». Так, несмотря на архаичность языка Мейоу, в его идеях еще 1674 года отразилось совершенно современное представление о кислороде. [4]
2. Распространенность природе
Из всех веществ в природе кислород наиболее распространен. В основном он содержится в связанном виде в земной коре в виде силикатов, карбонатов, сульфатов, оксидов железа, кварца и т.п. Всего примерно в полутора тысячах соединений. Самое важное соединение кислорода – оксид водорода. Вода составляет 50-99% массы любого живого существа.
Почти половина массы твердой земной коры — это кислород: земная кора до глубины 10-15 км на 50% ее веса состоит из кислорода. Песок содержит 53% кислорода, глина – 56%, человеческий организм в свою очередь – 65%.
В атмосфере Земли кислород находится в свободном состоянии: здесь его 21 % по объему (Рисунок 2) или 23 % по массе. Огромное количество кислорода (86 - 89 % по массе с учетом растворенных в воде солей) содержит гидросфера Земли – моря и океаны. Он содержится в каждой клетке живых организмов, в белках, углеводах, жирах; может составлять до 85% массы. Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %. [5]
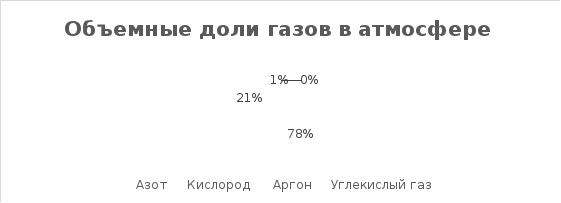
 Рис.
2 Объемные доли газов в атмосфере
Рис.
2 Объемные доли газов в атмосфере
Содержание кислорода в атмосфере пополняется за счет фотосинтеза, фитопланктона мирового океана и, в определенной степени, за счет лесов. [см. Приложение 2]
Все растения Земли в течение года создают около 300 млрд. т кислорода. В темновой фазе фотосинтеза из углекислого газа и воды происходит синтез глюкозы и кислорода (Уравнение 1):
6СО2 + 6Н2О + Qсвета → С6Н12О6 + 6О2 (1)
