
- •Лекція 2 періодичний закон д.І. Менделєєва і періодична система елементів. Будова атома
- •2.1 Історія відкриття періодичного закону
- •2.2 Періодична система хімічних елементів
- •2.3 Сучасні уявлення про будову атомів хімічних елементів
- •2.4 Стан електронів в атомі. Квантові числа
- •2.5 Будова атомів і періодична система елементів
- •2.6 Залежність властивостей елементів від будови їх атома
- •2.7 Енергія йонізації, енергія спорідненості до електрона. Електронегативність хімічних елементів
- •Контрольні питання
2.4 Стан електронів в атомі. Квантові числа
Підтверджена експериментально в 1927 р. дуалістична природа електрона, що володіє властивостями не лише частинки, а й хвилі спонукала вчених до створення нової теорії будови атома, що враховує ці властивості. Дуалістичність властивостей електрона проявляється в тому, що він, з одного боку, володіє властивостями частинки (має певну масу спокою), а з іншого – його рух нагадує хвилю і може бути описаний певною амплітудою, довжиною хвилі, частотою коливань. Тому не можна говорити про певну траєкторію руху електрона, можна судити лише про ступінь імовірності знаходження електрона в даній точці простору – його електронну орбіталь.
Отже, електронна орбіталь – це деяка частина простору навколо ядра, в межах якого імовірність перебування електрона максимальна. В зв’язку з цим електрон зображають не у вигляді матеріальної точки, а ніби „розмазаним“ по всьому об’єму атома у вигляді так званої „електронної хмари“, що має області згущення і розрідження електричного заряду.
Для атома Гідрогену, який складається з одного протона і одного електрона на рис 2.1 схематично зображено його „електронну хмару“.

Рисунок 2.1 – Електронна хмара електрона атома Гідрогену
Згідно сучасних уявлень стан будь-якого електрона в атомі описується чотирма квантовими числами.
Головне квантове число n – характеризує величину енергії електрона і приймає лише позитивні цілочисельні значення 1, 2, 3, ... ∞. Із збільшенням n енергія електрона зростає.
Побічне (орбітальне) квантове число l – описує форму електронної хмари. При певному головному квантовому числі n орбітальне квантове число l може приймати будь-які цілочисельні значення від 0 до n – 1. Відповідні орбіталі позначаються буквами латинського алфавіту s (l = 0), p (l = 1), d (l = 2), f (l = 3). Орбітальне квантове число відображає енергію електрона на підрівні. Число можливих підрівнів кожного енергетичного рівня співпадає з порядковим номером рівня. Так, першому енергетичному рівню відповідає s-підрівень, другому – два підрівня: s- і p-, третьому – три підрівні: s-, p- і d-, четвертому – чотири: s-, p-, d- і f-орбіталі.
Магнітне
квантове число m
– визначає просторову орієнтацію
атомних орбіталей. При даному орбітальному
квантовому числі l
магнітне квантове число m може
приймати будь-які цілочисельні значення
від –l... 0...+l.
Воно визначає число орбіталей одного
енергетичного рівня: існує одна s-орбіталь
(m = 0), три p-орбіталі
(m = –1(рх); 0(рy);
+1(pz),
п’ять d-орбіталей
(m = –2(![]() );
–1(
);
–1(![]() );
0(
);
0(![]() );
+1(
);
+1(![]() );
+2(
);
+2(![]() )
(рис. 2.2), сім f-орбіталей
(m = –3; –2; –1; 0; +1; +2; +3).
)
(рис. 2.2), сім f-орбіталей
(m = –3; –2; –1; 0; +1; +2; +3).


Рисунок 2.2 – Форми граничних поверхонь s-, p- i d-орбіталей
Спінове квантове число ms – визначає власний магнітний момент електрона. Приймає значення –1/2 або +1/2.
Таким чином, кожен електрон в атомі характеризується чотирма квантовими числами. Три з них n, l, m – характеризують орбіталь, на якій перебуває електрон, четверте ms – орієнтацію вектора спіна. Швейцарський учений В. Паулі (1900-1958 рр.) сформулював важливий принцип, який ще називають „забороною“ Паулі:
атом не може мати двох електронів з однаковими значеннями всіх чотирьох квантових чисел;
на кожній орбіталі можливе перебування лише двох електронів, спіни яких протилежно напрямлені.
Використовуючи принцип Паулі, можна розрахувати максимальне число електронів на енергетичних рівнях і підрівнях. Таким чином на s-орбіталі максимальна кількість електронів – два (s2), на p-орбіталі – шість (p6), на d-орбіталі – десять (d10), на f-орбіталі – чотирнадцять електронів (f14).
Заповнення електронами підрівнів залежить від їх енергії. Згідно з принципом мінімуму енергії найстійкішому стану ē в атомі відповідає мінімальна енергія, тобто електрон займає атомну орбіталь (АО) з найнижчою енергією (енергія залежить від значень двох квантових чисел n і l ). Послідовність заповнення підрівнів електронами визначається правилом Клечковського:
енергетичні підрівні заповнюються за зростанням суми n+l;
якщо для двох підрівнів ця сума є однаковою, то нижчу енергію має підрівень з меншим значенням n.
В багатоелектронних атомах заповнення електронами всіх енергетичних рівнів і підрівнів залежно від їхньої енергії відбувається у такій послідовності:
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
АО |
1s |
2s2p |
3s3p |
4s3d4p |
5s4d5p |
6s4f5d6p |
7s5f6d7p |
де n – енергетичний рівень; АО – атомна орбіталь.
Електрони, розміщені на одному підрівні, мають однакові значення п і l, і тому (якщо немає зовнішніх полів) однакову енергію, незалежно від того, на якій орбіталі вони розташовані. Тому можна припустити кілька варіантів розміщення електронів в межах одного неповністю заповненого підрівня. Наприклад, якщо на p-підрівні перебувають два електрони, можна припустити існування таких станів:
а)
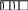
![]() ;
б)
;
б)
 ; в)
; в)
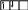 .
.
За правилом, сформульованим німецьким вченим Гундом: електрони на орбіталях одного підрівня розподіляються так, щоб їх сумарне спінове число тs було максимальним.
Для стану „а“ тs = +1/2 + 1/2 = 1; для станів „б“ і „в„ тs = +1/2 + (–1/2) = 0. Таким чином, відповідно до правила Гунда, найстійкішим буде стан „а“, коли електрони в межах підрівня розміщуються на різних орбіталях і мають однаковий спін.
Оскільки електрони – це негативно заряджені частинки, вони відштовхуються один від одного і тому займають різні орбіталі. Такий стан найбільш енергетично вигідний. Коли ж вільних комірок на підрівні не залишається, електрони спаровуються. Саме в цьому полягає фізичний зміст правила Гунда.
