
- •39. Предмет химической кинетики
- •Вопрос 44. Температурный коэффициент скорости реакции. Уравнение Вант- Гоффа. Метод ускоренного старения лекарств.
- •Вопрос 45. Теория переходного состояния. Общие закономерности катализа.
- •Вопрос 46. Гомогенно-каталитические процессы. Кислотно-основной катализ. Ферментативный катализ. Примеры.
- •Вопрос 47. Гетерогенно-каталитические процессы. Факторы, влияющие на скорость гетерогенного катализа. Кинетика гетерогенного катализа.
- •Вопрос 48. Теория гетерогенного катализа: мультиплетная, активных ансамблей, электронно- химическая. Роль катализа в фармации.
39. Предмет химической кинетики
Химическая кинетика — наука о скоростях и механизмах химических реакций.
В отличие от термодинамики, химическая кинетика изучает протекание химических реакций во времени.
Химическая кинетика решает следующие задачи, перечисленные в порядке сложности их решения:
1. Установление экспериментальным путем зависимости между скоростью химической реакции и условиями ее проведения, т. е. концентрацией реагентов и продуктов, концентрацией катализатора (если он есть в системе), температурой, давлением и т. д.
На основе этого дается количественное описание хода химической реакции во времени в виде математических формул, называемых кинетическими уравнениями. Знание этих уравнений позволяет оптимизировать химический процесс, т. е.:
а) вести его в условиях, обеспечивающих максимальный выход целевых продуктов, минимальный выход побочных продуктов и минимальный расход реагентов. Это снижает расход сырья, улучшает качество продукта за счет уменьшения содержания примесей, повышает экологическую безопасность процесса;
б) вести процесс при оптимальных температуре Т и давлении Р. Оптимизация Т снижает расход энергии на проведение процесса. Расход энергии можно также снизить, если добиться совмещения его эндотермических и экзотермических стадий. Оптимизация Р снижает капитальные затраты на строительство реакторов.
Знание кинетических закономерностей важно также при хранении и эксплуатации химических продуктов, когда надо замедлить их деструкцию. Это важно, например, при хранении пищевых продуктов, лекарств, топлив, полимеров.
2. Установление механизма химической реакции, т. е. выяснение элементарных стадий, из которых она состоит, и идентификация активных промежуточных частиц, ответственных за осуществление этих стадий. Знание механизмов позволяет сознательно управлять процессом.
3. Установление связи между строением химических соединений и их реакционной способностью. Знание такой связи позволяет предсказывать химические свойства веществ, целенаправленно искать новые химические реакции, новые вещества с ожидаемым комплексом свойств. Большая роль в решении этой задачи отводится теоретическим методам расчета констант скорости элементарных реакций и теоретическим методам расчета кинетики сложных реакций как совокупности элементарных реакций разных типов.
В сжатой форме эти три основные задачи химической кинетики можно сформулировать так: изучение химических превращений, предсказание их и управление ими
. По механизму химические реакции делят на простые и сложные. К простым относятся реакции, которые протекают только в одну стадию. Например, разложение галогенов: Если же реакция протекает в несколько стадий, то она является сложной. Например, реакция разложения пероксида водорода записывается суммарным уравнением:
2Н2О2 = 2Н2О + О2
Однако эта реакция протекает в две стадии и является сложной:
1) Н2О2 = Н2О + О
2) О + О = О2.
По числу фаз химические реакции делят на гомогенные - протекают в одной фазе и гетерогенные - протекают на границе раздела фаз.
ГОМОГЕННЫЕ РЕАКЦИИ, хим. р-ции, протекающие полностью в одной фазе. Примеры гомогенных реакций в газовой фазе: термич. разложение оксида азота 2N2O5 -> 4NO2 + О2; хлорирование метана СН4 + С12 -> СН3С1 + НС1; горение этана 2С2Нб + 7О2 -> 4СО2 + 6Н2О; образование озона в земной атмосфере ЗО2 -> 2О3.
. Типичные гетерогенные реакции: термич. разложение солей с образованием газообразных и твердых продуктов (напр., СаСО3 -> СаО + СО2), восстановление оксидов металлов водородом или углеродом (напр., РЬО + С -> Рb + СО), растворение металлов в к-тах (напр., Zn + + H2SO4 -> ZnSO4 + Н2),
40. Скорость реакции характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в функции времени. Уравнение, описывающее зависимость скорости реакции (v) от концентрации (с) реагирующих веществ, называется кинетическим. Скорость реакции чаще выражают в моль/л-с, в биохимии в мг/100мл-с, или в массовой доле, в %/100 мл-с. Различают среднюю скорость реакции в интервале времени и истинную скорость реакции в определенный момент времени. Если в интервале времени t1 и t2 концентрация одного из исходных веществ или продуктов реакции равна соответственно с1 и с2, то среднюю скорость реакции (v) в интервале времени t1 и t2 можно выразить:

Поскольку речь идет в данном случае об убыли концентрации исходного вещества, т.е. изменение концентрации вещества берется в этом случае со знаком «минус» (-). Если скорость реакции оценивается изменением (увеличением) концентрации одного из продуктов реакции, то со знаком «плюс» (+):

По уравнению (2.2) определяют среднюю скорость химической реакции. Истинную (мгновенную) скорость реакции определяют графически. Строят график зависимости концентрации исходного вещества или продукта реакции (Са) от времени (t) - кинетическую кривую реакции Са - f(t) для нелинейного процесса (рис. 2.1).
В каждый момент времени (например, t1) истинная скорость реакции равна тангенсу угла наклона касательной к кинетической кривой в точке, соответствующей данному моменту времени. Согласно графику мгновенная скорость реакции будет рассчитываться по формуле:

Физические методы. При исследовании газовых реакций часто проводятся измерения давления или объема газа. Однако такие измерения имеют смысл, лишь если число молей газообразных реагентов отличается от числа молей газообразных продуктов. Если же число молей газообразных реагентов совпадает с числом молей газообразных продуктов, в результате реакции не происходит изменений давления. Это следует из закона Авогадро. В приведенной ниже реакции на три моля газообразных реагентов приходится два моля газообразных продуктов. Это позволяет прослеживать скорость протекания данной реакции, измеряя давление или объем газообразной системы:
2NO (г.) + O2 (г.) = 2NO2 (г.)
Однако в реакции между водородом и иодом не происходит изменения объема: H2(r.) + l2(g.)=2HI(r.)
Факторы влияющие на скорость реакции
-природа реагирующих веществ
-концентрация реагирующих веществ
-поверхность соприкосновения реагирующих веществ(в гетерогенных реакциях)
-температура
-действие катализатора
41 Закон действующих масс он формулируется так: скорость простой химической реакции пропорциональна концентрации взаимодействующих частиц.
Интуитивно закон действующих масс кажется очевидным и можно было бы принять

Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. По числу молекул, принимающих участие в элементарном акте химического превращения, различают реакции моно (одно), би (2) тримолекулярные реакции. Вероятность соударения одновременно большего числа частиц очень мала; поэтому тримолекулярные реакции очень редки, а 4х неизвестны.
![]()
![]()
![]()
![]()
![]()
![]() тримолекулярная
тримолекулярная
Сумма показателей степеней в кинетических уравнениях называется порядком реакции. Порядок реакции определяет характер зависимости V от С.
В тех случаях, когда процесс многостадиен, запись уравнения реакции лишь фиксирует исходное и конечное состояние системы, не раскрывая механизма процесса.
Если различие концентраций реагентов велико, то порядок реакции не совпадает с её молекулярностью.
Существуют реакции нулевого порядка, например, разложение некоторых соединений на поверхности различных фаз. Реакции нулевого порядка
Для
реакций нулевого порядка :кинетическое
уравнение имеет следующий вид:
(V=K0).Скорость
реакции нулевого порядка постоянна во
времени и не зависит от концентраций
реагирующих веществ; это характерно
для многих гетерогенных (идущих на
поверхности раздела фаз) реакций в том
случае, когда скорость диффузии реагентов
к поверхности меньше скорости их
химического .Первый порядок : выражение
для константы скорости односторонней
реакции первого порядка:
![]()
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной.
![]() Как
видно из полученного выражения, период
полупревращения реакции первого порядка
не зависит от начальной концентрации
исходного вещества.
Как
видно из полученного выражения, период
полупревращения реакции первого порядка
не зависит от начальной концентрации
исходного вещества.
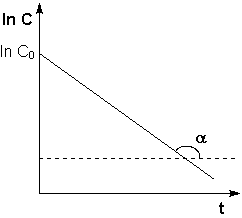
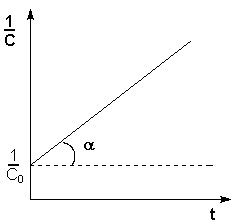
Второй
порядок: Т.о., для реакций второго
порядка, имеющих кинетическое уравнение
вида (II.14), характерна линейная зависимость
обратной концентрации от времени (рис.
2.4) и константа скорости равна тангенсу
угла наклона прямой к оси времени:
![]()
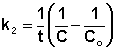
![]()
Третий порядок реакции: Скорость реакции третьего порядка может зависеть от концентрации одного реагента в третьей степени.

42.Методы определения порядка реакции Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический
метод заключается в построении графика
зависимости концентрации реагента от
времени в различных координатах. Для
различных порядков эти зависимости
и меют
след.вид:
меют
след.вид:

Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
43.ТАС.Энергия активации.Уравнение Аррениуса |
 где k — константа
скорости реакции,
где k — константа
скорости реакции, ![]() — фактор
частоты для
реакции,
— фактор
частоты для
реакции, ![]() — универсальная
газовая постоянная,
— универсальная
газовая постоянная, ![]() — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Энергия активации— минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Аррениусом. Типичное обозначение энергии реакции Ea.
.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
Молекулы должны быть правильно ориентированы относительно друг друга.
При
низкой (для определённой реакции)
температуре большинство молекул
обладают энергией меньшей, чем энергия
активации, и неспособны преодолеть
энергетический барьер.
 где
k — константа скорости реакции, —
фактор частоты для реакции, —
универсальная газовая постоянная, —
температура в кельвинах
где
k — константа скорости реакции, —
фактор частоты для реакции, —
универсальная газовая постоянная, —
температура в кельвинах
Вант
Гоффа: повышение температуры на 10 К
увеличивает для большинства реакций
скорость в 2-4 раза. Математически это
означает, что скорость реакции зависит
от температуры степенным образом:
![]() где \gamma — температурный коэффициент
скорости (его значение лежит в интервале
от 2 до 4). Правило Вант-Гоффа является
весьма грубым и применимо только в
очень ограниченном интервале температур:
от 10 до 400 ˚С, а также при энергии активации
от 60 до 120 кДж/моль. Правило Вант-Гоффа
не работает с крупными молекулами.
где \gamma — температурный коэффициент
скорости (его значение лежит в интервале
от 2 до 4). Правило Вант-Гоффа является
весьма грубым и применимо только в
очень ограниченном интервале температур:
от 10 до 400 ˚С, а также при энергии активации
от 60 до 120 кДж/моль. Правило Вант-Гоффа
не работает с крупными молекулами.
