
- •Часть 1
- •Раздел 1. Механика (повторение 9 класса).
- •Раздел 2. Основы молекулярно-кинетической теории.
- •Раздел 3. Основы термодинамики.
- •Раздел 1.
- •Механика (повторение 9 класса).
- •Тема №1.
- •Введение.
- •Тема №2. Основы кинематики.
- •Тема №3. Основы динамики.
- •Тема №4. Законы сохранения в механике.
- •Раздел 2.
- •Тема №2. Макро- и микропараметры. Идеальный газ. Основное уравнение мкт идеального газа.
- •Тема №3. Температура – мера средней кинетической энергии теплового движения частиц.
- •Тема №4. Уравнение состояния идеального газа. Изопроцессы. Закон дальтона.
- •Тема №5. Строение и свойства жидкостей и твердых тел. Поверхностное натяжение.
- •Тема №6. Испарение. Насыщенный пар. Влажность воздуха.
- •Раздел 3.
- •Тема №2. Внутреннея энергия, теплота и работа в термодинамике.
- •Тема №3.
- •Тема №4.
- •Физические постоянные:
- •Литература:
- •Часть 1. Молекулярная физика.
Тема №2. Внутреннея энергия, теплота и работа в термодинамике.
На ряду с механической энергией тела обладают ещё и энергией заключенной внутри самих тел – внутренней энергией. Внутренняя энергия равна сумме кинетической энергии беспорядочного движения всех молекул системы относительно ее центра масс и потенциальной энергии взаимодействия этих молекул между собой.
Внутренняя энергия одноатомного идеального газа равна:
![]() ;
;
![]() .
.
Существует два способа изменения внутренней энергии: совершение механической работы над системой и теплообмен с другими системами.
Работа газа в
термодинамике равна:
![]() ,
где p –
давление газа, ΔV
- изменение объема газа.
,
где p –
давление газа, ΔV
- изменение объема газа.
Существует три
вида
теплообмена:
теплопроводность,
конвекция
и тепловое
излучение.
Количество энергии, отданное или
полученное телом при теплообмене,
называется количеством
теплоты (теплотой):
![]() .
.
Теплота, необходимая для изменения температуры тела, равна:
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
c
– удельная теплоёмкость вещества;
![]() .
.
Теплота
необходимая для плавления и кристаллизации,
равна:
![]() ;
;
λ
– удельная теплота плавления;
![]() .
.
Теплота,
необходимая для парообразования и
конденсации:
![]() ;
;
L
– удельная теплота плавления;
![]() .
.
Теплота,
выделяемая при сгорании топлива,
равна:
![]() ;
;
q
– удельная теплота сгорания топлива;
![]() .
.
Уравнение
теплового баланса:
в замкнутой системе тел алгебраическая
сумма количеств теплоты, отданных и
полученных всеми телами, участвующими
в теплообмене, равна нулю:
![]() .
.
Тема №3.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОППРОЦЕССАМ В ИДЕАЛЬНОМ ГАЗЕ. АДИАБАТНЫЙ ПРОЦЕСС.
Закон сохранения энергии: энергия в природе не возникает из ничего и не исчезает; количество энергии неизменно, оно лишm переходит из одной формы в другую.
Закон сохранения
энергии применительно к тепловым
процессам называется первым
законом термодинамики:
количество теплоты, сообщенное системе,
расходуется на увеличение ее внутренней
энергии и на работу, совершаемую системой
против внешних сил:
![]() .
С учетом того, что работа внешних сил
А'
противоположна
работе системы А
(А'=-
А), первый
закон термодинамики
можно записать в следующем виде: изменение
внутренней энергии системы равно сумме
сообщенного ей количества теплоты и
работы, произведенной над системой
внешними силами:
.
С учетом того, что работа внешних сил
А'
противоположна
работе системы А
(А'=-
А), первый
закон термодинамики
можно записать в следующем виде: изменение
внутренней энергии системы равно сумме
сообщенного ей количества теплоты и
работы, произведенной над системой
внешними силами:
![]() .
.
Первый закон термодинамики доказывает невозможность создания вечного двигателя – устройства, способного неограниченно долго совершать работу без получения энергии извне.
Первый закон термодинамики применительно к различным изопроцессам:
Изотермический процесс:
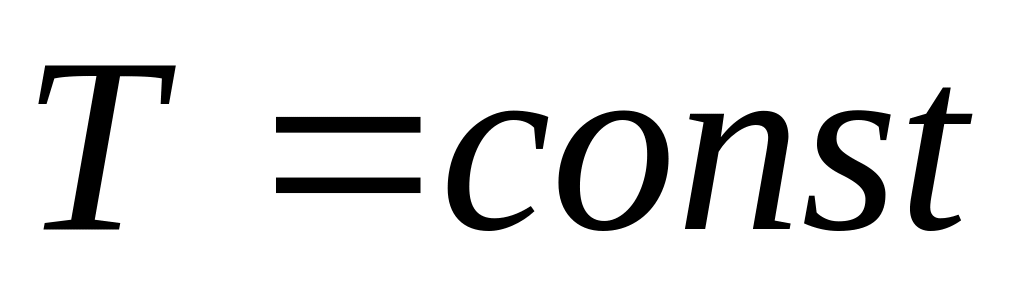 ,
,
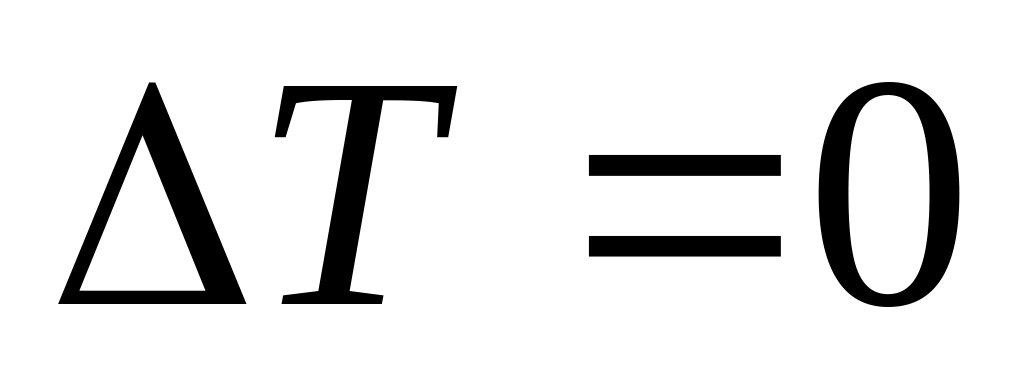 ,
,
 ,
,
 .
.Изохорный процесс:
 ,
,
 ,
,
 ,
,
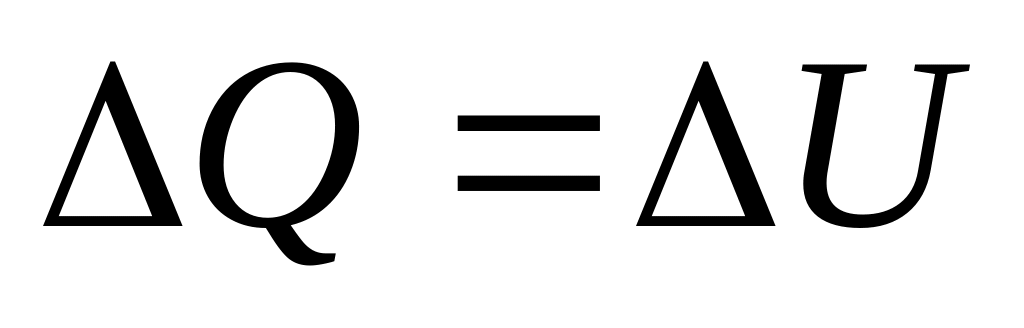 .
.Изобарный процесс:
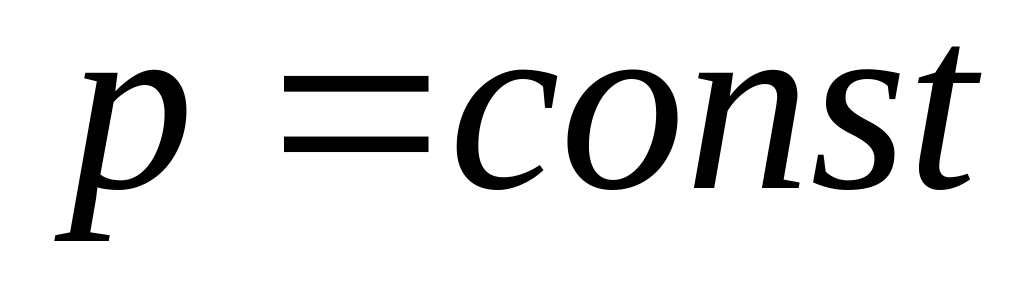 ,
.
,
.Адиабатный процесс – изопроцесс, идущий без обмена теплотой между системой и окружающей средой:
 ,
,
 .
.
Тема №4.
ПРИНЦИП ДЕЙСТВИЯ ТЕПЛОВЫХ МАШИН. ТЕПЛОВЫЕ ДВИГАТЕЛИ. КПД ТЕПЛОВЫХ ДВИГАТЕЛЕЙ. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ИСПОЛЬЗОВАНИЯ ТЕПЛОВЫХ ДВИГАТЕЛЕЙ.
Тепловой двигатель – устройство, преобразующее внутреннюю энергию сгоревшего топлива в механическую энергию. Виды тепловых двигателей: 1) двигатели внутреннего сгорания: а) дизельные, б) карбюраторные; 2) паровые двигатели; 3) турбины: а) газовые, б) паровые.
Все названые тепловые двигатели имеют разную конструкцию, но состоят из трех основных частей: нагревателя, рабочего тела и холодильника. Нагреватель обеспечивает поступление теплоты в двигатель. Рабочее тело превращает часть полученной теплоты в механическую работу. Холодильник забирает от рабочего тела часть теплоты.

T1 – температура нагревателя;
T2 –температура холодильника;
Q1 – теплота, полученная
от нагревателя;
Q2 – теплота, отданная
холодильнику;
A' – работа, выполненная
двигателем.
Работа любого теплового двигателя состоит из повторяющихся циклических процессов – циклов. Цикл – это такая последовательность термодинамических процессов, в результате которых система возвращается в начальное состояние.
Коэффициент
полезного действия (КПД)
тепловой машины – это отношение
совершенной двигателем работы к
количеству теплоты, полученному от
нагревателя:
![]() .
.
Французский
инженер Сади Карно рассмотрел идеальную
тепловую машину
с идеальным газом в качестве рабочего
тела. Он нашел оптимальный идеальный
цикл теплового двигателя, состоящий из
двух изотермических и двух адиабатических
обратимых процессов – цикл
Карно. КПД
такой тепловой машины с нагревателем
при температуре
![]() и холодильником при температуре
и холодильником при температуре
![]() :
:
![]() .
Независимо от конструкции, выбора
рабочего тела и типа процессов в тепловом
двигателе его КПД не может быть больше
КПД теплового двигателя, работающего
по циклу Карно, и имеющего те же, что и
у данного теплового двигателя, температуру
нагревателя и холодильника.
.
Независимо от конструкции, выбора
рабочего тела и типа процессов в тепловом
двигателе его КПД не может быть больше
КПД теплового двигателя, работающего
по циклу Карно, и имеющего те же, что и
у данного теплового двигателя, температуру
нагревателя и холодильника.
КПД тепловых двигателей невысок, поэтому важнейшей технической задачей является его повышение. Тепловые двигатели имеют два существенных недостатка. Во-первых, в большинстве тепловых двигателей используется органическое топливо, добыча которого быстро истощает ресурсы планеты. Во-вторых, в результате сгорания топлива в окружающую среду выбрасывается огромное количество вредных веществ, что создает значительные экологические проблемы.
С изучением вопроса о максимальном КПД тепловых машин связано открытие в 1850 г. немецким физиком Р. Клазиусом второго начала термодинамики: невозможен такой процесс, при котором теплота самопроизвольно переходила бы от более холодных тел к более горячим телам.
Физические величины и их единицы измерения:
Наименование величина |
Обозначение |
Единица измерения |
Формула |
Относительная молекулярная масса |
Mr (эм эр) |
безразмерная величина |
|
Масса одной молекулы (атома) |
m0 |
кг |
|
Масса |
m |
кг |
|
Молярная масса |
M |
|
|
Количество вещества |
ν (ню) |
моль (моль) |
; |
Число частиц |
N (эн) |
безразмерная величина |
|
Давление |
p (пэ) |
Па (паскаль) |
|
Концентрация |
n (эн) |
|
|
Объём |
V (вэ) |
|
|
Средняя кинетическая энергия поступательного движения молекулы |
|
Дж (джоуль) |
|
Температура по шкале Цельсия |
t |
°C |
|
Температура по шкале Кельвина |
T |
К (кельвин) |
|
Средняя квадратичная скорость молекул |
|
|
|
Поверхностное натяжение |
σ (сигма) |
|
|
Абсолютная влажность |
ρ (ро) |
|
|
Относительная влажность |
φ (фи) |
% |
|
Внутренняя энергия |
U (у) |
Дж (джоуль) |
|
Работа |
А (а) |
Дж (джоуль) |
|
Количество теплоты |
Q (ку) |
Дж (джоуль) |
|
