
- •6.1.1. Внутренняя энергия и энтальпия
- •6.1.2. Экзо- и эндотермические процессы
- •6.1.3. Термохимия; закон Гесса
- •6.1.4. Энтальпии образования веществ
- •6.1.5. Расчет тепловых эффектов химических реакций
- •6.2. Скорость химических реакций
- •6.2.1. Понятие скорости реакции
- •6.2.2. Зависимость скорости реакции от концентрации; порядок и молекулярность реакции
- •6.2.3. Зависимость скорости реакции от температуры
- •6.3. Понятие о катализе и катализаторах
- •6.4. Химическое равновесие
- •6.5. Принцип Ле Шателье
- •Урок"Скорость химической реакции.Факторы, влияющие на скорость химической реакции"
- •Содержание урока
- •1. Организация класса
- •4. Закрепление первичных знаний о скорости химической реакции
- •Глава III §§ 14 -16 стр. 43
- •5. Скорость химической реакции при 20 °с равна 1 моль/л • с. Вычислите скорость этой реакции при 60 °с, если температурный коэффициент равен 3.
6.2.1. Понятие скорости реакции
Раздел химии, в котором рассматриваются скорость и механизмы химических реакций называетсяхимической кинетикой. Одним из ключевых понятий в химической кинетике является скорость химической реакции.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени при неизменном объеме системы.
Рассмотрим следующий процесс:
А = В + С.
Пусть в какой–то момент времени t1 концентрация вещества А равна величине с1, а в момент t2 – величине с2. За промежуток времени от t1 до t2, изменение концентрации составит Δс = с2 – с1. Средняя скорость реакции равна:
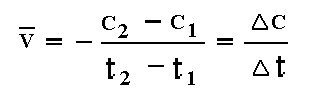 .
.
Знак минус ставится потому, что по мере протекания реакции (Δt>0) концентрация вещества уменьшается (Δс<0), в то время, как скорость реакции является положительной величиной.
×Ads by Plus-HD-V1.9cСкорость химической реакции зависит от природы реагирующих веществ и от условий протекания реакций: концентрации, температуры, присутствия катализатора, давления (для газовых реакций) и некоторых других факторов. В частности, при увеличении площади соприкосновения веществ скорость реакции увеличивается. Скорость реакции также возрастает при увеличении скорости перемешивания реагирующих веществ.
Численное значение скорости реакции зависит также от того, по какому компоненту рассчитывается скорость реакции. Так, например, скорость процесса
Н2 + I2 = 2HI,
рассчитанная по изменению концентрации HI в два раза больше скорости реакции, вычисленной по изменению концентрации реагентов Н2 или I2.
6.2.2. Зависимость скорости реакции от концентрации; порядок и молекулярность реакции
Основной закон химической кинетики – закон действующих масс –устанавливает зависимость скорости реакции от концентрации реагирующих веществ.
Скорость реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции, записанной в общем виде как
аA + bB = cC + dD,
зависимость скорости реакции от концентрации имеет вид:
v = k [A]α [B]β .
В данном кинетическом уравнении k – коэффициент пропорциональности, называемый константой скорости; [A] и [B] – концентрации веществ А и В. Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций. Коэффициентыα и β находят из экспериментальных данных.
Сумма показателей степеней в кинетических уравнениях называется общим порядком реакции. Различают также частный порядок реакции по одному из компонентов. Например, для реакции
Н2 + С12 = 2 НС1
Кинетическое уравнение выглядит так:
v = k[H2][Cl2]1/2,
т.е. общий порядок равен 1,5 а порядки реакции по компонентам Н2 и С12 равны соответственно 1 и 0,5.
×Ads by Plus-HD-V1.9cМолекулярность реакции определяется числом частиц, одновременным соударением которых осуществляется элементарный акт химического взаимодействия.Элементарный акт (элементарная стадия) – единичный акт взаимодействия или превращения частиц (молекул, ионов, радикалов) в другие частицы. Для элементарных реакций молекулярность и порядок реакции совпадают. Если процесс многостадиен и поэтому запись уравнения реакции не раскрывает механизма процесса, порядок реакции не совпадает с ее молекулярностью.
Химические реакции подразделяют на простые (одностадийные) и сложные, протекающие в несколько стадий.
Мономолекулярная реакция – это реакция, в которой элементарный акт представляет собой химическое превращение одной молекулы. Например:
СН3СНО(г) = СН4(г) + СО(г) .
Бимолекулярная реакция – реакция, элементарный акт в которой осуществляется при столкновении двух частиц. Например:
H2(г) + I2(г) = 2 HI(г).
Тримолекулярная реакция – простая реакция, элементарный акт которой осуществляется при одновременном столкновении трех молекул. Например:
2NO(г) + O2(г) = 2 NO2(г).
Установлено, что одновременное столкновение более чем трех молекул, приводящее к образованию продуктов реакции, практически невозможно.
Закон действующих масс не распространяется на реакции, протекающие с участием твердых веществ, поскольку их концентрации постоянны и они реагируют лишь на поверхности. Скорость таких реакций зависит от величины поверхности соприкосновения между реагирующими веществами.
