
- •Общие замечания к проведению практикума
- •III. Техника безопасности
- •Лабораторная работа №1
- •Краткое теоретическое введение
- •Порядок выполнения работы
- •I.По ниже приведенным методикам нужно получить следующие лиофобные золи:
- •1.Получение золя серы в воде методом замены растворителя
- •2. Получение золя методом восстановления.(пока не делаем)
- •3. Получение золей реакцией двойного обмена
- •4. Получение золя берлинской лазури пептизацией пасты
- •5) Получение золя жедезисто-синеродистой меди реакцией обмена
- •II. По ниже приведенным методикам нужно получить следующие лиофильные золи:
- •III. Определение конуса Тиндаля.
- •Обработка результатов измерений
- •Опыт 3. Зависимость устойчивости эмульсии от концентрации эмульгатора.
- •Экспериментальная часть
- •Опыт 1. Зависимость времени жизни пены от концентрации пенообразователя
- •Набухание эластичных гелей
- •Контракция набухания эластичных гелей
- •Теплота набухания эластичных гелей
- •Влияние рН среды на набухание гелей
- •Влияние электролитов на набухание гелей
- •Порядок выполнения работы
- •Лабораторная работа № 6.
- •Порядок выполнения работы
- •Краткое теоретическое введение Адсорбция пав из растворов на твердом адсорбенте.
- •Реактивы, посуда и оборудование
- •Порядок выполнения работы
- •Часть 1
- •Часть 2
- •Обработка результатов измерений и содержание отчета
- •Часть 1
- •Определение концентрации растворов уксусной кислоты до и после адсорбции
- •Экспериментальные результаты адсорбции уксусной кислоты на угле
- •Значения адсорбции, рассчитанные различными методами
- •Часть 2.
- •Контрольные вопросы
Порядок выполнения работы
I.По ниже приведенным методикам нужно получить следующие лиофобные золи:
1.Получение золя серы в воде методом замены растворителя
Сера практически нерастворима в воде. Поэтому вливанием неводного раствора серы в воду при сильном перемешивании может быть получен «белый золь» серы. Роль стабилизатора играют продукты окисления и ничтожные примеси. Устойчивый золь серы получается с использованием сероводорода. Стабилизатором частиц в этом случае являются продукты окисления Н2S, в частности H2S5O6 пентатионовая кислота. К 1 мл 1%-го спиртового раствора серы в колбе на 25 мл добавить при встряхивании 10 мл воды. Вследствие понижения растворимости серы в новом растворителе, раствор становится пересыщенным и часть серы конденсируется, образуя частицы дисперсной фазы – золь серы.
2. Получение золя методом восстановления.(пока не делаем)
Нитрат серебра легко восстанавливается в щелочной среде. Внести пипеткой 1 мл 0,1 Н раствора азотнокислого серебра в 100 мл дистиллированной воды. Добавить 2–3 капли 1%-го раствора K2CO3 и 1 мл 0,1%-го раствора таннина и нагреть. Уравнения реакции:
AgNO3 + K2CO3 = AgOK + KNO3 + СО2↑
6AgOK + C76H52O46 + 3H2O = 6Ag + 6KOH + C76H52O49
|
|
3. Получение золей реакцией двойного обмена
Соли сульфата бария труднорастворимы в воде и при смешении раствора сульфатно-кислого раствора с раствором хорошо растворимой соли бария, должны выпадать в осадок. Однако, если смешать разбавленные растворы и взять один из реагентов в избытке, то соль сульфата бария не выпадет в осадок, а образуется коллоидный раствор. Избыток одного из реагентов является стабилизатором, при этом стабилизатором могут быть как ВаСl2, так и K2SO4. От того, какой из реагентов взят в избытке, зависят физико-химические свойства полученного золя, в частности знак заряда его частиц.
Для получения золей BaSO4 в одну колбу пипеткой наливают 10 мл 0,01 N раствора ВаСl2 и затем медленно, по каплям, из бюретки добавляют 9 мл 0,01 N раствора K2SO4, в другую колбу наливают пипеткой 10 мл 0,01 N раствора K2SO4 и по каплям добавляют 9 мл 0,01 N раствора ВаСl2. В обоих случаях в результате химической реакции обмена по уравнению
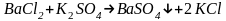
получается белый золь сульфата бария, однако в зависимости от состава стабилизатора его мицеллы будут иметь различные формулы, а частицы – различные знаки заряда.
4. Получение золя берлинской лазури пептизацией пасты
Для получения пасты берлинской лазури к 10 мл насыщенного раствора желтой кровяной соли K4[Fe(CN)6] приливают по каплям 2 мл насыщенного раствора FeCl3. Получается черная паста.
Для получения из пасты золя следует крупинку пасты стеклянной палочкой внести в пробирку или в стаканчик с дистиллированной водой. В результате пептизации пасты получается ярко-синий золь берлинской лазури

5) Получение золя жедезисто-синеродистой меди реакцией обмена
0,5 мл 20 %-го раствора K4[Fе(СN)6] разбавляют водой до 100 мл в колбе емкостью на 250 мл. В разбавленный раствор прибавляют при взбалтывании 11-12 капель 10%-го раствора СuSO4. Получается очень устойчивый красно-бурый золь.
K4[Fе(СN)6] + СuSO4 → Сu2[Fе(СN)6] + K2SO4
