
- •110900 – Технология производства и переработки сельскохозяйственной продукции
- •111100 – Зоотехния
- •Тема 1 основные понятия и законы химии
- •Вариант 1
- •Вариант 2
- •Сделайте расчет и заполните таблицу:
- •Вариант 3
- •Сделайте расчет и заполните таблицу:
- •Вариант 4
- •Сделайте расчет и заполните таблицу:
- •Вариант 5
- •Сделайте расчет и заполните таблицу:
- •Вариант 6
- •Сделайте расчет и заполните таблицу:
- •Вариант 7
- •Сделайте расчет и заполните таблицу:
- •Вариант 8
- •Сделайте расчет и заполните таблицу:
- •Вариант 9
- •Сделайте расчет и заполните таблицу:
- •Вариант 10
- •Сделайте расчет и заполните таблицу:
- •Вариант 11
- •Сделайте расчет и заполните таблицу:
- •Вариант 12
- •Сделайте расчет и заполните таблицу:
- •Тема 2 строение атома
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Тема 3 химическая связь
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Тема 4 оксиды и кислоты
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Тема 5 основания, соли
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Тема 6 основные законы протекания химических реакций: тепловые эффекты, скорость реакции, химическое равновесие
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Тема 7 окислительно-восстановительные процессы
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Тема 8 растворы
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Тема 9 химические свойства металлов
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Тема 10 азот, фосфор, сера
- •Тема 11 комплексные соединения
- •Содержание
- •Тема 1 основные понятия и законы химии 3
- •110900 – Технология производства и переработки сельскохозяйственной продукции
- •111100 – Зоотехния
- •440014, Г. Пенза, ул. Ботаническая, 30
Вариант 9
Охарактеризуйте закон сохранения массы веществ.
Сделайте расчет и заполните таблицу:
№ |
Формула вещества |
Масса |
Количество |
Объем данного количества вещества при н. у. (указать только для газов) |
||
одного моля |
вещества, г |
молей |
молекул |
|||
1 |
СО2 |
|
|
0,2 |
|
|
Н2SО4 |
|
4,9 |
|
|
|
|
3. Определите молярную массу следующих веществ: ВCI3; KOH; Br2.
Вариант 10
Охарактеризуйте закон Эквивалентов.
Сделайте расчет и заполните таблицу:
№ |
Формула вещества |
Масса |
Количество |
Объем данного количества вещества при н. у. (указать только для газов) |
||
одного моля |
вещества, г |
молей |
молекул |
|||
1 |
СН4 |
|
4 |
|
|
|
СuSO4 |
|
|
2 |
|
|
|
3. Определите молярную массу следующих веществ: Р2О5; NH4CI; J.
Вариант 11
Охарактеризуйте закон Авогадро.
Сделайте расчет и заполните таблицу:
№ |
Формула вещества |
Масса |
Количество |
Объем данного количества вещества при н. у. (указать только для газов) |
||
одного моля |
вещества, г |
молей |
молекул |
|||
1 |
CI2 |
|
|
|
3,01*1022 |
|
NaNO3 |
|
|
0,2 |
|
|
|
3. Определите молярную массу следующих веществ: Na2SO4; MnO2; Zn (OH)2.
Вариант 12
Охарактеризуйте закон постоянства состава.
Сделайте расчет и заполните таблицу:
№ |
Формула вещества |
Масса |
Количество |
Объем данного количества вещества при н. у. (указать только для газов) |
||
одного моля |
вещества, г |
молей |
молекул |
|||
1 |
О2 |
|
|
|
|
5,6 |
КNO3 |
|
20 |
|
|
|
|
3. Определите молярную массу следующих веществ: Н2ZnO2; Br2; AgOH
Тема 2 строение атома
Развитие представлений о строение атома. Основные принципы квантовой теории строения вещества: двойственная природа частиц микромира, принцип неопределенности. Уравнение Шредингера, волновая функция, атомная орбиталь. Квантовые числа: главное, орбитальное, магнитное, спиновое. Энергетические уровни и подуровни атома.
Принципы заполнения электронных орбиталей атома в основном состоянии: принцип Паули, правило Хунда, правило В. М. Клечковского Электронные емкости орбиталей, подуровней и уровней атома. Электронные и электронно-структурные (графические) формулы атома.
Ядро атома. Состав атома, его заряд. Порядковый номер и массовое число элементов. Изотопы и изобары. Значение теории строения атома в химии и биологии.
Вариант 1
Сформулируйте постулаты Бора.
Какие числовые значения принимает побочное квантовое число при значении главного квантового числа n = 3? Укажите их буквенные значения.
Составьте электронную и электронно-структурную формулы атома марганца
 .
Укажите, сколько протонов и нейтронов
в ядре атома этого элемента.
.
Укажите, сколько протонов и нейтронов
в ядре атома этого элемента.
Вариант 2
Сформулируйте принцип Паули.
Каково максимальное количество электронов в подуровне d и уровне L?
Составьте электронную и электронно-структурную формулы атома хлора. Укажите, чем отличается состав ядер изотопов
 и
и
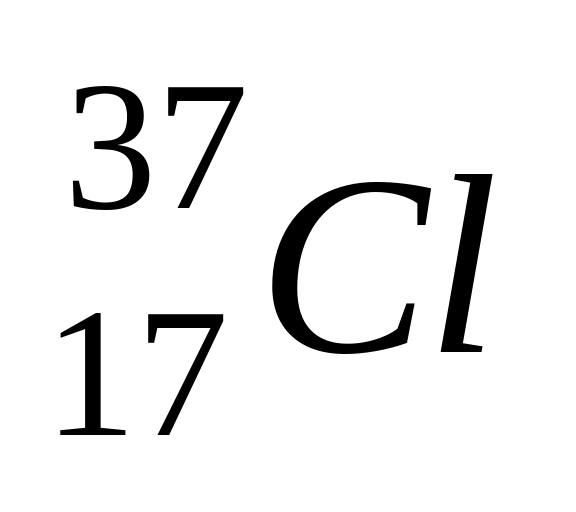 .
.
Вариант 3
Сформулируйте правило Хунда.
Какие числовые значения принимает квантовое число l при значении главного квантового числа n = 4? Укажите их буквенные значения.
Составьте электронную и электронно-структурную формулы ванадия
 .
Укажите, сколько нейтронов содержится
в ядре атома этого элемента.
.
Укажите, сколько нейтронов содержится
в ядре атома этого элемента.
Вариант 4
Сформулируйте закономерности, установленные Мозли при изучении рентгеновских спектров атомов элементов.
Каково максимальное количество электронов в подуровне f и уровне М?
Изобразите расположение электронов по энергетическим ячейкам в атоме железа. Сравните структурные символы
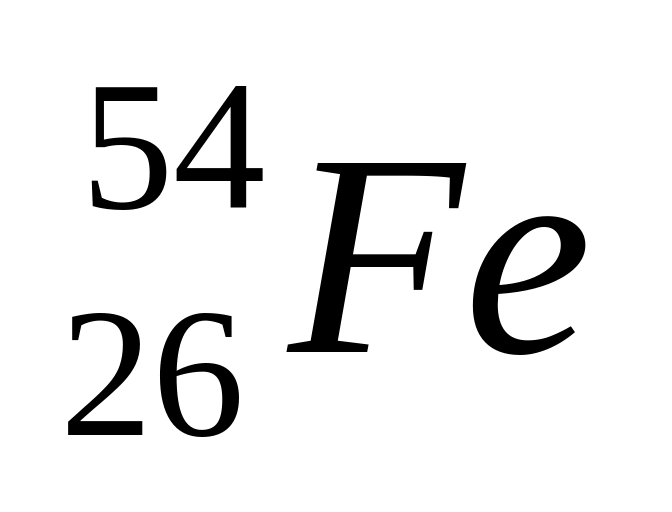
 ,
определите состав ядер этих атомов и
укажите, как называют такие пары атомов.
,
определите состав ядер этих атомов и
укажите, как называют такие пары атомов.
Вариант 5
Сформулируйте правило Клечковского.
Что характеризует спиновое квантовое число? Какое числовое значение оно может принимать?
Составьте электронную и электронно-структурную формулы атома кислорода. Укажите, сколько протонов и нейтронов содержится в атомах
 и
и
 .
Одинаковы ли электронные формулы этих
атомов?
.
Одинаковы ли электронные формулы этих
атомов?
Вариант 6
Каков физический смысл порядкового номера элемента в системе Д. И. Менделеева?
Сколько электронов может максимально располагаться в подуровне р? Как, в соответствии с правилом Хунда, располагаются в энергетических ячейках 3р-подуровня четыре электрона в атоме серы?
Составьте электронную формулу скандия
 .
Сколько свободных ячеек в 3d-подуровне
этого атома? Сколько нейтронов в ядре
атома?
.
Сколько свободных ячеек в 3d-подуровне
этого атома? Сколько нейтронов в ядре
атома?
