
- •Биосинтез белка, этапы. Посттрансляционный процессинг белка, значение в биосинтезе белков. Регуляция биосинтеза белков. Ингибиторы биосинтеза белков и нуклеиновых кислот
- •Гниение белков и аминокислот (триптофана, тирозина, лизина, орнитина) в кишечнике. Обезвреживание продуктов гниения белков в организме.
- •Номенклатура и классификация ферментов. Современные представления о механизме ферментативного катализа. Активаторы и ингибиторы ферментов.
- •Классификация углеводов: моносахариды, олигосахариды, гомополисахариды, гетерополисахариды. Гликозаминогликаны, протеогликаны, схема структурной организации протеогликанов, функции.
- •Холестерол и желчные кислоты, представление об эмульгировании жиров. Структура и классификация фосфолипидов.
- •Гликолиз. Брожение. Основные функции. Ферменты и коферменты. Регуляция.
- •Раздел 8.5
- •Раздел 8.6
- •Пентозофосфатный путь окисления глюкозы. Ферменты. Реакции.
- •Глюконеогенез. Стадии. Регуляция глюконеогенеза.
- •Цикл Кребса. Основные стадии. Ферменты и коферменты. Ингибиторы и регуляторы
- •Дыхательная цепь Цитохромы. Убихинон. Железосерные белки. Цитохромоксидаза
- •Субстратное и окислительное фосфорилирование. Теория Митчелла.
- •Фотосинтетические пигменты. Электротранспортная система фотосинтеза. Фотофосфорилирование. Цикл Кальвина
- •Витамины и витаминоподобные вещества: химическая природа, классификация, роль в обмене веществ
- •Классификации гормонов. Химическая природа гормонов. Механизм действия гормонов: мембранный, мембранно-клеточный, цитозольный. Ткани-мишени. Рецепторы гормонов.
- •23.2. Иерархия регуляторных систем в организме.
- •23.3. Механизмы действия гормонов.
- •23.4. Гормоны гипоталамуса и гипофиза.
- •28.4. Гормоны поджелудочной железы.
- •28.5. Гормоны мозгового вещества надпочечников.
1
L- и D-аминокислоты. Заменимые и незаменимые аминокислоты. Протеиногенные аминокислоты. Структурная организация белков. Формирование трехмерной структуры белка в клетке.
1.Большинство аминокислот содержит асимметрический атом углерода (у α-аминокислот это α-углеродный атом) и может существовать в виде оптических изомеров:
При установлений конфигурации аминокислот их принято сравнивать с L- и D-молочными кислотами, конфигурации которых установлены по L- и D-глицериновым альдегидам.
В природе встречаются только оптически активные аминокислоты, причем подавляющее большинство их относится к L-ряду. D-Формы аминокислот сравнительно редки (они входят в состав некоторых антибиотиков).
Интересно отметить физиологическое отличие аминокислот D- и L-рядов. При реакциях, происходящих в организме под действием ферментов, превращениям, как правило, подвергаются L-аминокислоты и их производные (гидролиз ацилированных аминокислот, эфиров, пептидов). Обратные примеры встречаются значительно реже (одним из примеров может служить избирательное окисление D-аминокислот в кетокислоты под влиянием фермента, содержащегося в почках млекопитающих).

Синтетически полученные аминокислоты являются рацемическими смесями антиподов. Для их разделения могут быть использованы химические методы. Очень удобна, например, дробная кристаллизация солей дибензоил-D-винной кислоты с эфирами аминокислот.
Особое значение приобрели ферментативные методы расщепления рацемических аминокислот. Чаще всего для этого используется ацилаза — фермент, выделяемый из почек свиней. Разделяемую аминокислоту (например, D,L-аланин) ацетилируют и полученный ацетил-D,L-аланин обрабатывают в водном растворе аодлазой, под действием которой происходит стереоспецифический гидролиз L-ацетилаланина:

Образовавшийся свободный L-аланин легко отделяется от устойчивого к действию ацилазы ацетил-D-аланина, из которого путем кислотного гидролиза в жестких условиях можно получить свободную D-аминокислоту. Обе стереоизомерные аминокислоты удается при этом выделить с высокими выходами.
2. Незаменимые аминокислоты
Лизин входит в состав практически любых белков. Лизин также понижает уровень триглицеридов в сыворотке крови. Эта аминокислота оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес и острые респираторные инфекции. Хорошо сочетается с витамином С и биофлавоноидами. Метионин обеспечивает дезинтоксикационные процессы, прежде всего по связыванию тяжелых металлов, эндогенных и экзогенных токсинов, а также при токсикозе беременности. Метионин оказывает выраженное антиоксидантное действие, так как является хорошим источником серы, инактивирующей свободные радикалы. Помогает переработке жиров, предотвращая их отложение в печени и стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Метионин в организме переходит в цистеин, который является предшественником глутатиона. Треонин поддерживает липотропную функцию печени совместно с метионином и аспартамом. Треонин играет важную роль в образовании коллагена и эластина. Он повышает иммунитет, участвует в производстве антител. Фенилаланин принимает активное участие в синтезе белков, повышает умственную активность, память. Он способствует улучшению секреторной функции поджелудочной железы и печени. Из фенилаланина может образовываться тирозин, который используется для синтеза нейротрансмиттеров (передатчиков нервных импульсов), способствующих улучшению умственного восприятия, усиливая выработку гормонов щитовидной железы, также обладающих антидепрессантными свойствами. Триптофан необходим для производства витамина B3 (ниацина) и серотонина-важнейшего нейромедиатора, передающего нервные импульсы. Серотонин нормализует сон, стабилизирует настроение, снижает аппетит. Триптофан снижает содержание жиров, образующих холестерин в крови, также обладает гипотензивным свойством, расширяя кровеносные сосуды. Участвует в синтезе альбуминов и глобулинов, усиливает выделение гормона роста. Валин необходим для восстановления поврежденных тканей и метаболических процессов в мышцах при тяжелых нагрузках и для поддержания нормального обмена азота в организме, оказывает стимулирующее действие. Относится к разветвленным аминокислотам, может быть использован мышцами в качестве источника энергии вместе с лейцином и изолейцином. Лейцин, действуя вместе с валином и изолейцином, защищают мышечные ткани и является источником энергии, также способствует восстановлению костей, кожи, мышц. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. Изолейцин необходим для образования гемоглобина, стабилизирует уровень сахара в крови, восстанавливает мышечные ткани, ускоряет процесс выработки энергии.
Заменимые аминокислоты(синтезируемые в организме человека) Аланин нормализует метаболизм углеводов. Является составной частью таких незаменимых нутриентов как пантотеновая кислота и коэнзим А. Аргинин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность вилочковой железы, которая вырабатывает T-лимфоциты. Его также применяют при заболеваниях печени (цирроз и жировая дистрофия), он способствует дезинтоксикационным процессам в печени (прежде всего обезвреживанию аммиака). Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме. Стимулирует выработку гормона роста, что вызывает некоторое уменьшение запасов жира в организме. Аргинин повышает половую активность у мужчин за счет восстановления эректильной функции и стимуляции сперматогенеза. Аспарагиновая кислота в организме присутствует в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ. Участвует в образовании пиримидиновых оснований мочевины. Биологическое действие аспарагиновой кислоты: иммуномодулирующее, повышающее физическую выносливость, нормализующее баланс возбуждения и торможения в ЦНС. Гистидин усиливает секрецию соляной кислоты и пепсина в желудке. Стимулирует образование гемоглобина и кроветворение в целом. Гистидин способствует улучшению половой функции, так как гистамин (производное гистидина) положительно влияет на эректильную функцию и усиливает половое возбуждение. Глицин (аминоуксусная кислота) является центральным нейромедиатором тормозного типа действия, оказывает седативное действие, улучшает метаболические процессы в тканях мозга, ослабляет влечение к алкоголю, оказывает положительное влияние при мышечных дистрофиях, уменьшает повышенную раздражительность, нормализует сон. Глутаминовая кислота (глутамин) обладает уникальным свойством присоединять дополнительный атом азота, тем самым, являясь организатором синтеза различных белков (перенос азота), либо связывая избыток азота (в том числе аммиак), который может вызывать нарушение работы различных органов, но, прежде всего мозга и печени. В центральной нервной системе глутаминовая кислота является возбуждающим нейромедиатором. Глутаминовая кислота является важной составляющей мышечной ткани, воздействует на гормон роста. Пролин участвует в синтезе коллагена, восстанавливает структуру соединительной ткани (в том числе опорно-двигательного аппарата, паренхиматозных органов, сердца). Тирозин является предшественником нейромедиаторов норадреналина и дофамина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза. Симптомами дефицита тирозина также являются пониженное артериальное давление, низкая температура тела и синдром беспокойных ног. Тирозин может синтезироваться из фенилаланина в организме человека. Цистеин - серосодержащая аминокислота играет важную роль в процессах формирования тканей кожи. Имеет значение для дезинтоксикационных процессов. Цистеин входит в состав альфа-керотина, основного белка ногтей, кожи и волос. Он способствует формированию коллагена и улучшает эластичность кожи. Цистеин входит в состав и других белков организма, в том числе некоторых пищеварительных ферментов. Цистеин помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации. Цистеин является предшественником глютатиона - вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, в том числе содержащихся в сигаретном дыме. Эта аминокислота образуется в организме из метионина, при обязательном присутствии витамина B6. Карнитин становится пожалуй, самым популярным препаратом среди спортсменов. Но врачам следует обратить пристальное внимание на его биохимические свойства и лечебный эффект.
3. Алифатические аминокислоты:
а) моноаминомонокарбоновые – глицин, аланин, изолейцин, лейцин, валин;
б) оксимоноаминокарбоновые – серин, треонин;
в) моноаминодикарбоновые – аспаргиновая, глютаминовая;
г) амиды моноаминодикарбоновых кислот – аспарагин, глутамин;
д) диаминомонокарбоновые – аргинин, лизин;
е) серосодержащие – гистин, цистеин, метионин.
2. Ароматические аминокислоты: фенилаланин, тирозин.
3. Гетероциклические аминокислоты: триптофан, гистидин, пролин, оксипролин.
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
4. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. 1.4.2). Имейте в виду, что даже небольшие изменения первичной структуры белка могут значительно изменять его свойства. Примером заболеваний, развивающихся в результате изменения первичной структуры белка, являются гемоглобинопатии (гемоглобинозы) .
В эритроцитах здоровых взрослых людей присутствует гемоглобин А (Hb А) . В крови некоторых людей содержится аномальный (изменённый) гемоглобин - гемоглобин (Hb S). Единственное отличие первичной структуры Hb S от Hb A - замена гидрофильного остатка глутаминовой кислоты на гидрофобный остаток валина в концевом участке их β-цепей:
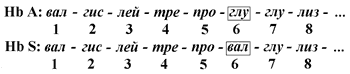
Как известно, основная функция гемоглобина -транспорт кислорода к тканям. В условиях пониженного парциального давления О2 снижается растворимость гемоглобина S в воде и его способность связывать и переносить кислород. Эритроциты принимают при этом серповидную форму, быстро разрушаются, вследствие чего развивается малокровие (серповидно-клеточная анемия] .
Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белка. Установлено, что каждой полипептидной последовательности соответствует только один стабильный вариант пространственной структуры. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг.
До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, без участия каких-либо компонентов. Однако сравнительно недавно обнаружилось, что это справедливо только для сравнительно небольших белков (порядка 100 аминокислотных остатков). В процессе фолдинга более крупных белков принимают участие специальные протеины - шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка.
Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО-и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α-спираль и β-складчатый слой.
α-Спираль - жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом СО-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм
Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Сα становится невозможным) , а также аминокислоты с заряженными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль.
β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.
Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать а-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации.
2.1.3. Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
Водородные связи образуются между двумя полярными незаряженными радикалами или между незаряженным и заряженным радикалами, например, радикалами серина и глутамина:
Ионные связи могут возникать между противоположно заряженными радикаламинапример, радикалами глутамата и аргинина:
Гидрофобные взаимодействия характерны для неполярных радикалов, например, валина и лейцина:
Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи:
По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К фибриллярным белкам относятся:
Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин.
Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин.
Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин.
2.1.4. Четвертичная структура белка - размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка.Четвертичная структура - высший уровень организации белковой молекулы, к тому же необязательный - более половины известных белков её не имеют. Белки, обладающие четвертичной структурой, называют также олигомерными белками, а полипептидные цепи, входящие в их состав, - субъединицами или протомерами. В некоторых белках такие субъединицы одинаковы или имеют сходное строение, а другие белки состоят из субъединиц с цепями разных типов.
Каждый из протомеров синтезируется в виде отдельной полипептидной цепи, которая сворачивается в глобулу и затем объединяется с другими путём самосборки. Каждая субъединица содержит участки, способные взаимодействовать с соответствующими участками других субъединиц. Эти взаимодействия осуществляются посредством водородных, ионных и гидрофобных связей между радикалами аминокислот, входящих в состав разных цепей.
Олигомерные белки могут существовать в виде нескольких устойчивых конформаций и обладают аллостерическими свойствами, то есть способны переходить из одной конформаций в другую с изменением своей функциональной активности. Примерами олигомерных белков могут служить эритроцитарный белок гемоглобин, фермент фосфофруктокиназа и многие другие.
Известны также белки, модекула которых состоит из двух или более полипептидных цепей, соединённых дисульфидными связями (инсулин, тромбин). Подобные белки нельзя олигомерными. Такие белки образуются из единой полипептидной цепи в результате частичного протеолиза - локального расщепления пептидных связей. Аллостерическими свойствами, характерными для олигомерных белков, такие белки не обладают.
2
Биосинтез белка, этапы. Посттрансляционный процессинг белка, значение в биосинтезе белков. Регуляция биосинтеза белков. Ингибиторы биосинтеза белков и нуклеиновых кислот
1. Биосинтез белков План:
1. Генетический код
2. Этапы биосинтеза белка
3. Регуляция синтеза белка
Транскрипция трансляция
ДНК → РНК → Белки → Регуляция метаболизма
Транскрипция – это синтез молекулы РНК или это процесс переписывания нуклеотидов гена с ДНК в РНК, всегда происходит на стадии двунитевой молекулы ДНК, при этом матрицей служит одна нить, которая называется антикодирующей.
Основные характеристики процесса транскрипции
1. РНК – копия содержит в себе весь объем информации определенного участка ДНК.
2. РНК сохраняет способность к образованию водородных связей между комплементарными основаниями (так как урацил, присутствующий в РНК вместо тимина спаривается с аденином)
3. Транскрипция отличается от репликации, при этом РНК-копия, после завершения ее синтеза освобождается от ДНК-матрицы, после чего происходит восстановление исходной двойной спирали ДНК.
4. Синтезирующие молекулы РНК имеют одноцепочечную структуру, она короче ДНК и соответствует длине участка ДНК, который достаточен для кодирования одного или нескольких белков.
Особенности данного процесса
1. В клетках эукариот – прежде чем превратится в и-РНК и попасть в цитоплазму, РНК претерпевает химические изменения.
2. В цитоплазме на каждой и-РНК синтезируются тысячи копий. Скорость этого процесса очень высока.
Генетический код
Генетический код – это аминокислотная последовательность белков. Он был расшифрован в 1961 году учеными Миренберпом и Маттеи. Они установили:
Кодирование аминокислот осуществляется триплетами нуклеотидов (кодонами) Из 4-х азотистых оснований можно составить 64 различные комбинации, которых достаточно для кодирования 20 аминокислот.
Кодон – это последовательность трех нуклеотидов, в результате которой кодируется определенная аминокислота.
Необходимо помнить, что:
Точность синтеза полипептидной цепи достигается за счет комплементарного узнавания азотистых оснований двух компонентов:
кодона информационной РНК антикодона транспортной РНК
Последовательность аминокислот в любом белке зависит от последовательности азотистых оснований в ДНК, содержащихся в той клетке, где синтезируется данный белок. Заложенная в ДНК информация считывается в процесс транскрипции матричной РНК (м-РНК) и переносится в белоксинтезирующую систему на рибосомы. Ученый Крик доказал триплетную теорию кодона, которая и объясняет способ перевода четырехбуквенного языка нуклеиновых кислот на 20-буквенный язык белковых молекул.
Кодон-антикодоновое взаимодействие – это способ узнавания триплетом (которым является м-РНК) комплементарного триплета (им является антикодон), входящего в состав соответствующей т-РНК.
Кодон и антикодон спариваются антипараллельным образом (теорий качаний Крика):
1. Два первых основания кодонов образуют прочные пары с соответствующими азотистыми основаниями антикодона.
2. Находящиеся в третьем положении азотистые основания кодонов образуют слабые водородные связи с антикодоном.
3. Вывод Крика: находящиеся в третьем положении основания большинства кодонов имеют некоторую степень свободы при образовании пары с соответствующими азотистым основанием антикодона – это и есть качающиеся основания.
4. Именно такое взаимодействие кодона с антикодоном обеспечивает включение аминокислоты в соответствующие участки полипептидной цепи синтезирующегося белка.
Этапы биосинтеза белка
1 этап – этап активации аминокислот
Компоненты:
1. 20 аминокислот
2. 20 ферментов аминоацил-т-РНК-синтетаз
3. 20 и более т-РНК, а также АТФ и ионы Мg²+
На этом этапее осуществляется АТФ-зависимые превращения аминокислот в аминоацил-т-РНК.
1 стадия – из аминокислоты и АТФ образуется аминоацил-аденилат – это активированное соединение (ангидрид), в котором карбоксильная группа аминокислоты соединена с фосфатной группой адениновой кислоты.
2 стадия – аминоацидная группа аминоацил-аденилата переносится на молекулу соответствующей т-РНК. В результате образуется аминоацил-т-РНК – это активированное соединение, участвующее в биосинтезе белка. Этот процесс активизируется аминоцаил-т-РНК-синтетазами.
Во всех случаях на 2-ой стадии активированная аминокислота присоединяется к остатку адениловой кислоты, или адениловому нуклеотиду в триплете ЦЦА (ССА) на третьем конце молекулы т-РНК (3’-Т-РНК).
Молекулы т-РНК переводят информацию, заключенную в и-РНК на язык белка.
Таким образом, генетический код расшифровывается с помощью двух адаптаров: это т-РНК и аминоцаил-т-РНК-синтетаза, в результате чего каждая аминокислота может занять место, определенное ей триплетной нуклеотидной последовательностью в и-РНК, т. е. своим кодоном.
Для дальнейшего синтеза необходимы рибосомы. Синтез белков, входящих в состав рибосомной структуры, происходит цитоплазме, самосборка – в ядрышке за счет взаимодействия молекул белков и рибосомной РНК при участии ионов Мg²+.
р-РНК выполняет роль каркасов для упорядоченного расположения рибосомных полипептидов.
Суб-частицы в рибосоме расположены несимметрично, имеют неправильную форму, и соединены друг с другом так, что между ними остается бороздка, через которую проходит молекула и-РНК в процесс синтеза полипептидной цепи, а также 2-ая бороздка, удерживающая растущую полипептидную цепь.
2 этап – Инициация полипептидной цепи
Компоненты:
1. и-РНК, гуанозинтрифосфат (ГТФ), ионы Мg²+
2. N-формилметионил-т-РНК
3. Инициирующий кодон в и-РНК
4. Рибосомные субчастицы (30S, 50S)
5. Факторы инициации (IF 1;2;3)
У E. coli и других прокариот N-концевой аминокислотой при сборке полипептидной цепи всегда является остаток N-формилметианила.
Стадии образования инициирующего комплекса
1 стадия
A) В результате взаимодействия 30S субъединицы (субчастицы) и фактора инициации образуется структура, в которой белок препятствует ее ассоциации с 50S субчастицей.
B) Присоединение к 30S субчастице и-РНК достигается с помощью инициирующего сигнала, представляющего собой богатую пуриновыми основаниями последовательность, центр которой находится на расстоянии 10 нуклеотидов от 5’-конца инициирующего кодона и-РНК.
C) Первый транслируемый кодон расположен на расстоянии 25 нуклеотидов от 5’ конца.
D) Инициирующий сигнал, представленный коротким участком и-РНК, в результате взаимодействия с комплементарной последовательностью нуклеотидов, расположенных с 3-го конца 30S субчастицы, способствует фиксированию и-РНК в нужном для инициации положении.
E) Это взаимодействие обеспечивает правильное положение инициирующего кодона на 30S субчастице.
2 стадия
A) К комплексу, состоящему из 30S субчастицы, фактора инициации и и-РНК, присоединяются ранее связавшиеся с N-формилметионилом т-РНК, второй фактор инициации и гуанозин-трифосфат (ГТФ).
B) Возникновение функционально активной 70S рибосомы а результате присоединения 50S-рибосомной субчастицы к ранее образовавшейся комплексной структуре.
3 стадия – приготовление инициирующего комплекса к продолжению процесса трансляции.
3 этап – Элонгация
На этой стадии происходит синтез полипептидной цепи.
Компоненты:
1. Инициирующий комплекс – 70S рибосома.
2. Набор аминоацил-т-РНК
3. Фактор элонгации, цианозинтрифосфат (ГТФ)
4. Пептидилтрансфераза, ионы Мg²+
Элонгация – это циклический процесс.
Стадии элонгации
1 стадия – образование аминоацил-т-РНК, которая является комплементарным кодон-антикодоновым взаимодействием, а также специфической связью между участками молекул т-РНК и р-РНК.
2 стадия - подготовка для вступления остатков аминокислот в реакцию образования пептидной связи.
3 стадия (транслокация) – это перемещение рибосомы вдоль и-РНК на один кодон. На образование однопептидной связи затрачивается энергия гидролиза 2-х молекул ГТФ.
A) Свободная т-РНК отделяется и уходит в цитоплазму.
B) В дальнейшем аминоацильный участок вновь подготовлен для связывания очередной аминоацил-т-РНК, антикодон который комплементарен следующему кодону и-РНК – начинается новый цикл элонгации.
4 этап – Терминация.
Компоненты:
АТФ Терминирующий кодон и-РНК Факторы освобождения полипептида
1) Рост полипептидной цепи продолжается, пока один из 3-х терминирующих кодонов (УАА, УГА, УАГ) не поступит в рибосому. В этом случае кодон-антикодо-нового взаимодействия не происходит.
2) К терминирующему кодону присоединяется ответственный за терминацию фактор, в результате прекращается дальнейший рост белковой цепи.
3) Синтезируемый белок, и-РНК и т-РНК определяются от рибосомы.
4) И0РНК распадается до свободных рибонуклеидов, а т-РНК и рибосомы, распавшись на две субъединицы, участвуют в новых циклах трансляции.
5 этап – Процессинг
Компоненты:
1. Специфические ферменты
2. Кофакторы
Образующиеся полипептидные цепи формируют более сложные белки или управляют процессами метаболизма в качестве ферментов.
На одной молекуле и-РНК работает несколько и более (до 100) рибосом. Они образуют полисому, и на каждой рибосоме строится своя полипептидная цепь (в биосинтезе гемоглобина участвуют полсомы из 5-6 рибосом).
Отличие биосинтеза белка
1. У прокариот – транскрипция и трансляция связаны между собой и синтез белка начинается сразу же на продолжающей синтезироваться молекуле и-РНК.
2. У эукариот – сначала на ДНК синтезируется и-РНК, затем она созревает и только зрелая участвует в трансляции.
Регуляция синтеза белка
В процессе эволюции был создан механизм регуляции действия генов. Геном каждой клетки приобрел характер комплекса, состоящего из:
Структурных генов, которые кодируют синтез белковых молекул (т-РНК и и-РНК); и Генов-регуляторов, которые обеспечивают упорядоченность в действии структурных генов.
Регуляция экспрессии (выражения) генов осуществляется на нескольких уровнях:
Генный – обусловлен изменением количества и локализации генов, контролирующих тот или иной признак. Транскрипционный – отвечает за то, какие и когда включать гены для наработки и-РНК. Трансляционный – обеспечивает отбор и-РНК, транслирующихся на рибосомах. Функциональный – связан с регуляцией активности ферментов.
2. В результате трансляции не всегда сразу образуется функционально активный белок. Во многих случаях необходимы дополнительные посттрансляционные изменения.
Посттрансляционная модификация (процессинг) белков менее распространена, чем процессинг РНК. Тем не менее известны случаи, когда при развитии некоторых вирусов трансляция поли-цистронной матрицы приводила к образованию общей полипептидной цепи, разрезаемой в дальнейшем на индивидуальные белки специфическими протеиназами. Кроме того, широко известен процессинг ряда ферментов (пищеварительных, инсулина и др.), превращающий их неактивные формы в активные.
У прокариот наиболее распространенным видом процессинга белков является удаление «сигнального» пептида из молекул секретируемых белков. Такие белки и ферменты (экзогидролазы, белки наружной мембраны и др.) содержат на NH2-Komi,e гидрофобный пептид из 15—30 аминокислот, который необходим для транслокации белка через цитоплазм атическую мембрану в процессе его синтеза. После завершения транслокации «сигнальный» пептид удаляется специальной «сигнальной» пептидазой (подробнее об экзо-ферментах — в главе, посвященной процессам экскреции).
К группе процессов посттрансляционной модификации можно отнести ферментативное присоединение коферментов (биотина, флавинов, гема и др.) к готовой молекуле апофермента, а также, с некоторой долей условности, и формирование мульти-мерных белков из нескольких полипептидных цепей с участием белков-шаперонов (стресс-белков, белков «теплового шока»).
3. Сущность этой теории сводится к "выключению" или "включению" генов как функционирующих единиц, к возможности или невозможности проявления их способности передавать закодированную в структурных генах ДНК генетическую информацию для синтеза специфических белков. Эта теория, доказанная в опытах на бактериях, получила широкое признание, хотя у эукариотов механизм регуляции синтеза белков, вероятнее всего, более сложный. У бактерий доказана индукция ферментов при добавлении в питательную среду субстратов этих ферментов. Добавление конечных продуктов реакции, образование которых катализируется этими же ферментами, напротив, вызывает уменьшение количества ферментов. Это последнее явление получило название репрессии. Оба этих явления, индукция и репрессия, взаимосвязанны.
Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. Именно эти гены в цепи ДНК служат основной матрицей для биосинтеза мРНК, которая затем поступает в рибосому и, как было указано выше, служит матрицей для биосинтеза белка.

Как видно из схемы, синтез мРНК на структурных генах молекулы ДНК непосредственно контролируется определенным участком, называемым оператором. Он служит как бы пусковым механизмом для функционирования структурных генов. Оператор локализован на крайнем отрезке структурного гена или структурных генов, регулируемых им. "Считывание" генетического кода, т. е. формирование мРНК, начинается с промотора - участка ДНК, являющегося точкой инициации для синтеза мРНК, и далее распространяется последовательно вдоль оператора и структурных генов. Координированный одним оператором одиночный ген или группа структурных генов образует оперон.
В свою очередь деятельность оперона находится под контролирующим влиянием другого участка цепи ДНК, получившего название гена-регулятора. Поскольку структурные гены и ген-регулятор находятся в разных участках цепи ДНК, связь между ними, как предполагают Жакоб и Моно, осуществляется при помощи вещества-посредника, оказавшегося белком и названного репрессором. Образование репрессора происходит в рибосомах ядра на матрице специфической мРНК, синтезированной на гене-регуляторе. Репрессор имеет сродство к оператору и обратимо соединяется с ним в комплексе. Образование такого комплекса приводит к блокированию синтеза мРНК, а следовательно, синтеза белка, т. е. функция гена-регулятора состоит в том, чтобы через белок-репрессор "запрещать" деятельность оперона (структурных генов), синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Когда такой индуктор соединяется с репрессором, последний теряет способность связываться с геном-оператором, который, таким образом, выходит из-под контроля гена-регулятора, и начинается синтез мРНК.
Это типичный пример отрицательной формы контроля, когда индуктор, соединяясь с белком-репрессором, вызывает изменения его третичной структуры настолько, что он теряет способность связываться с геном-регулятором. Здесь мы видим также аналогию взаимоотношения аллостерического центра фермента с эффектором. При образовании такого комплекса изменяется третичная структура фермента и он теряет способность связываться со своим субстратом.
Механизм описанной регуляции синтеза белка и взаимоотношения репрессора со структурными генами были доказаны в опытах с Е. coli, на примере синтеза галактозидазы, фермента, гидролизующего молочный сахар на глюкозу и галактозу. Дикий штамм Е. coli, обычно растущий на глюкозе, не может расти, если вместо глюкозы в питательную среду добавить лактозу (новый источник энергии и углерода) до тех пор, пока не будут синтезироваться подходящие ферменты (адаптивный синтез). При поступлении в клетку лактозы (индуктора) молекулы ее связываются с белком-репрессором и блокируют связь между репрессором и оператором. При этом оператор и структурные гены "освобождаются от запрещения" и начинают синтезировать необходимую мРНК, которая "дает команду" рибосомам синтезировать галактозидазу. Одновременно ген-регулятор продолжает вырабатывать репрессор, но он блокируется новыми молекулами лактозы, поэтому синтез фермента продолжается. Как только молекулы лактозы будут полностью расщеплены, репрессор освобождается и, поступив в ДНК, связывает оператор и блокирует синтез мРНК, а следовательно, синтез галактозидазы в рибосомах.
Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от состояния репрессора. Если репрессор, который представляет собой белок, состоящий из четырех субъединиц с общей молекулярной массой около 150 000, находится в активном состоянии, не связан с индуктором, он блокирует ген-оператор и не происходит синтез мРНК. При поступлении метаболита в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижая его сродство к гену-оператору). Структурные гены выходят из-под контроля и начинают синтезировать нужную мРНК.

Выше было указано, что концентрация ряда ферментов в клетках резко снижается при увеличении концентрации конечных продуктов реакций, образующихся данными ферментами. Такой эффект, получивший название репрессии ферментов, имеет место чаще всего в синтетических реакциях. В этих случаях оказалось, что молекулы репрессора, также образующиеся в рибосомах ядра по "команде" гена-регулятора, являются неактивными и сами по себе не обладают способностью подавлять деятельность гена-оператора и, следовательно, всего оперона, но приобретают такую способнсть после образования комплекса с конечными или одним из конечных продуктов синтетической реакции (рис. 119).
Конечный продукт выступает, таким образом, в качестве корепрессора. Имеются данные, показывающие, что в качестве корепрессоров в синтезе ферментов обмена аминокислот, например, выступает не свободная аминокислота как конечный продукт биосинтетической реакции, а комплекс ее с тРНК - аминоацил-тРНК.
Таким образом, концепция Жакоба и Моно о механизме проявления активности генов признана одним из блестящих достижений молекулярной биологии. Она явилась логическим развитием многочисленных исследований, проведенных генетиками и биохимиками в предшествующие десятилетия.
В заключение следует вкратце рассмотреть вопрос о регуляции процессов дифференцировки клеток высших организмов. ДНК, присутствующая во всех соматических клетках, вероятнее всего, имеет одинаковую первичную структуру у данного организма и соответственно располагает информацией для синтеза любых или всех белков тела. Тем не менее клетки печени, например, синтезируют сывороточные белки, а клетки молочной железы - белки молока. Нет сомнения в том, что в дифференцированных клетках, очевидно, существует тонкий механизм контроля деятельности ДНК в разных тканях, обеспечивающий синтез многообразия белков.
Механизмы, лежащие в основе этой регуляции, пока неизвестны. Для объяснения их имеется ряд гипотез. В частности, предполагается, что контроль осуществляется на уровне транскрипции по аналогии с индукцией ферментов у бактерий, и что в этом случае в клетках животных должны функционировать аналогичные репрессоры. Поскольку с молекулой ДНК у эукариотов связаны гистоны, считается, что именно они выполняют роль репрессоров. Однако прямых доказательств их роли в качестве репрессоров почти нет, как нет и точных данных о существовании каких-либо репресоров в клетках эукариотов. Высказано также мнение, что в ядре синтезируется гигантская молекула мРНК, содержащая информацию для синтеза широкого разнообразия белков, но в цитоплазму попадает только небольшая часть, а главная часть распадается. Неясно, однако, каков механизм избирательного распада мРНК.
Имеется еще одно предположение, что на ДНК клетки синтезируются все возможные мРНК, которые поступают в цитоплазму, и процесс трансляции регулируется путем специфического и избирательного взаимодействия репрессоров с определенными молекулами мРНК. Будущее покажет, какой из этих механизмов регуляции наиболее точно отражает истину.
4. Одним из путей выяснения механизмов синтеза нуклеиновых кислот и белков в клетках является путь синтеза таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерии, не оказывая влияния на организм человека. Ряд препаратов действительно обладает аналогичным действием, однако многие из них оказываются токсичными для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена ниже с целью выяснения механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Одним из мощных ингибиторов белкового синтеза является пуромицин. Из-за структурного сходства его с концевым остатком адениловой кислоты в аминоацил-тРНК он легко взаимодействует с пептидил-тРНК с образованием пептидил-пуромицина. Поскольку пептидил-пуромицин не несет на себе триплета антикодона, он тем самым тормозит элонгацию пептидной цепи, вызывая обрыв реакции. Затем свободные пептидил-пуромицины освобождаются из рибосомы. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo.

Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, но вследствие высокой токсичности применяется редко. Он оказывает тормозящее влияние на синтез всех типов клеточной РНК, в особенности мРНК. Это свойство вызвано тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней. Можно считать, что актиномицин ингибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используёмый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу путем связывания с ферментом. Наиболее чувствительна к нему бактериальная РНК-полимераза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина. Следует указать на недавно открытое противовирусное действие рифамицина, в частности он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. По-видимому, этот антибиотик найдет применение в лечении опухолей, вызываемых вирусами.
Выяснены механизмы действия ряда других антибиотиков, применяемых при лечении тифозных инфекций. Так, хлорамфеникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (в стадии элонгации) синтеза белка в 70S рибосоме бактерий. На этот процесс в 80S рибосоме он не действует. Противоположным тормозящим действием на синтез белка в 80S (без поражения процесса в 70S рибосоме) обладает циклогексимид, оказавшийся ингибитором транслоказы.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Оказалось, что чувствительность бактерий к стрептомицину связана с присутствием единственного белка в 30S субчастице рибосомы. Высказано предположение, что стрептомицин и неомицин вызывают ошибки в трансляции мРНК, приводящие к нарушению соответствия между Кодонами и включаемыми аминокислотами; например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, - в результате образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считается, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S субчастице рибосомы. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из чедущих стадий процесса трансляции.
Известные к настоящему времени данные о пенициллинах свидетельствуют о том, что они не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомального механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т. е. тормозят синтез белка в клетках животных.
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат изменения генетического кода (см. выше, гемоглобин при серповидно-клеточной анемии), структурно и функционально неполноценные. Последствия этого нарушения могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально.
3
